
- •45. Матричный синтез
- •46. Общие положения теории овр
- •47. Метод полуреакций
- •48. Количественная характеристика окислительно-восстановительных реакций
- •49. Использование стандартных электродных потенциалов для сравнения ов свойств веществ и определения возможности осуществления овр.
- •50. Зависимость электродного потенциала от концентрации
- •51 Уравнение Нернста
- •52. Диаграммы Латимера
- •53. Диаграммы Фроста
- •54. Факторы, влияющие на величину реального ов потенциала:
- •55. Диаграммы e–рН, диаграмма e–рН для воды
- •56. Овр в твердой фазе.
- •57. Окислительно-восстановительные реакции в газовой фазе
- •58. Механизмы каталитических реакций окисления
30.
Равновесие фаз в термодинамике — состояние, при котором фазы в термодинамической системе находятся в состоянии теплового, механического и химического равновесия.
Типы фазовых равновесий:
Тепловое равновесие означает, что все фазы вещества в системе имеют одинаковую температуру.
Механическое равновесие означает равенство давлений по разные стороны границы раздела соприкасающихся фаз. Строго говоря, в реальных системах эти давления равны лишь приближенно, разность давлений создается поверхностным натяжением.
Химическое равновесие выражается в равенстве химических потенциалов всех фаз вещества.
Условие равновесия фаз (не обязательно)
Рассмотрим химически однородную систему (состоящую из частиц одного типа). Пусть в этой системе имеется граница раздела между фазами 1 и 2. Как было указано выше, для равновесия фаз требуется равенство температур и давлений на границе раздела фаз. Известно, что состояние термодинамического равновесия в системе с постоянными температурой и давлением соответствует точке минимума потенциала Гиббса.
Потенциал Гиббса такой системы будет равен
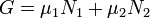 ,
,
где ![]() и
и ![]() — химические
потенциалы, а
— химические
потенциалы, а ![]() и
и ![]() —
числа частиц в первой и второй фазах
соответственно.
—
числа частиц в первой и второй фазах
соответственно.
При этом сумма ![]() (полное
число частиц в системе) меняться не
может, поэтому можно записать
(полное
число частиц в системе) меняться не
может, поэтому можно записать
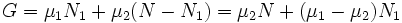 .
.
Предположим, что ![]() ,
для определенности,
,
для определенности, ![]() .
Тогда, очевидно, минимум потенциала
Гиббса достигается при
.
Тогда, очевидно, минимум потенциала
Гиббса достигается при ![]() (все
вещество перешло в первую фазу).
(все
вещество перешло в первую фазу).
Таким образом, равновесие фаз возможно только в том случае, когда химические потенциалы этих фаз по разные стороны границы раздела равны:
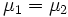 .
.
31.
Фазой называется совокупность однородных частей системы, одинаковых во всех точках по физическим, химическим и термодинамическим свойствам и отделенных от других фаз границей раздела. Системы, состоящие из одной фазы (f=1), называются гомогенными, из нескольких фаз (f>1) – гетерогенными. Например, смесь газов Не, Аr и Н2 – гомогенная система, а смесь кристаллов NaCl и КСl – гетерогенная, так как состоит из двух фаз.
Cоставная часть (составляющее вещество) – это такая часть системы, которая может существовать вне данной системы. Водный раствор NaCl состоит из двух частей – воды и хлорида натрия: хотя в нем нет молекул NaCl, а только ионы Na+ и Сl–, но они вне данной системы существовать не могут.
Составляющие вещества, наименьшее количество которых необходимо для однозначного выражения состава системы, называются компонентами. Так как свойства системы зависят только от их числа, в качестве компонентов можно выбрать любые составляющие вещества. Чтобы рассчитать число компонентов (k), нужно от числа составных частей системы отнять число уравнений, связывающих в условиях равновесия их концентрации (или парциальные давления).
( возможно это определение проще?)
Фаза – это вещество или раствор, все составные части которого описываются одним и тем же уравнением состоянии. Или: фаза – это вещество или раствор, свойства которого при переходе от одного состава к другому меняются непрерывно.
Классификация фазовых переходов
При фазовом переходе первого рода скачкообразно изменяются самые главные, первичные экстенсивные параметры: удельный объём, количество запасённой внутренней энергии, концентрация компонентов и т. п. Подчеркнём: имеется в виду скачкообразное изменение этих величин при изменении температуры, давления и т. п., а не скачкообразное изменение во времени (насчёт последнего см. ниже раздел Динамика фазовых переходов).
Наиболее распространённые примеры фазовых переходов первого рода:
плавление и кристаллизация
испарение и конденсация
сублимация и десублимация
При фазовом переходе второго рода плотность и внутренняя энергия не меняются, так что невооружённым глазом такой фазовый переход может быть незаметен. Скачок же испытывают их производные по температуре и давлению: теплоёмкость, коэффициент теплового расширения, различные восприимчивости и т. д.
Фазовые переходы второго рода происходят в тех случаях, когда меняется симметрия строения вещества (симметрия может полностью исчезнуть или понизиться). Описание фазового перехода второго рода как следствие изменения симметрии даётся теорией Ландау. В настоящее время принято говорить не об изменении симметрии, но о появлении в точке перехода параметра порядка, равного нулю в менее упорядоченной фазе и изменяющегося от нуля (в точке перехода) до ненулевых значений в более упорядоченной фазе.
Наиболее распространённые примеры фазовых переходов второго рода:
прохождение системы через критическую точку
переход парамагнетик-ферромагнетик или парамагнетик-антиферромагнетик (параметр порядка — намагниченность)
переход металлов и сплавов в состояние сверхпроводимости (параметр порядка — плотность сверхпроводящего конденсата)
переход жидкого гелия в сверхтекучее состояние (п.п. — плотность сверхтекучей компоненты)
переход аморфных материалов в стеклообразное состояние
Современная физика исследует также системы, обладающие фазовыми переходами третьего или более высокого рода.
Фазовые переходы первого рода — фазовые переходы, при которых скачком изменяются первые производные термодинамических потенциалов по интенсивным параметрам системы (температуре или давлению). Переходы первого рода реализуются как при переходе системы из одного агрегатного состояния в другое, так и в пределах одного агрегатного состояния (в отличие от фазовых переходов второго рода, которые происходят в пределах одного агрегатного состояния).
Примеры фазовых переходов первого рода
при переходе системы из одного агрегатного состояния в другое: кристаллизация (переход жидкой фазы в твердую), плавление (переход твердой фазы в жидкую), конденсация (переход газообразной фазы в твердую или жидкую), возгонка (переход твердой фазы в газообразную), эвтектическое, перитектическое и монотектическое превращения.
в пределах одного агрегатного состояния: эвтектическое, перитектическое и полиморфное превращения, распад пересыщенных твердых растворов, распад (расслоение) жидких растворов, упорядочение твердых растворов.
Иногда к фазовым переходам первого рода относят также мартенситные превращения (условно, так как в ходе мартенситного превращения реализуется переход в стабильное, но неравновесное состояние — метастабильное состояние).
32.
Фа́зовая диагра́мма (диаграмма состоя́ния) — графическое отображение равновесного состояния бесконечной физико-химической системы при условиях, отвечающих координатам рассматриваемой точки на диаграмме (носит название фигуративной точки).
Понятие диаграммы состояния однокомпонентной системы
Рассмотрим диаграмму состояния однокомпонентной системы на примере диаграммы состояния воды.
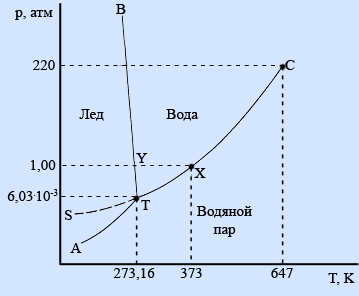
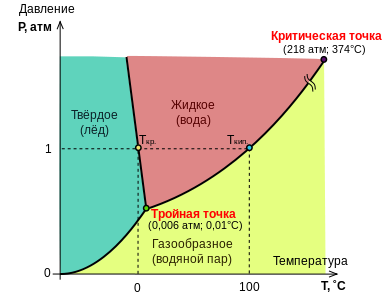
Фазовая диаграмма воды
Области фазовой диаграммы, ограниченные кривыми, соответствуют тем условиям (температурам и давлениям), при которых устойчива только одна фаза вещества. Например, при любых значениях температуры и давления, которые соответствуют точкам диаграммы, ограниченным кривыми ВТ и ТС, вода существует в жидком состоянии. При любых температуре и давлении, соответствующих точкам диаграммы, которые расположены ниже кривых АТ и ТС, вода существует в парообразном состоянии.
Кривые фазовой диаграммы соответствуют условиям, при которых какие-либо две фазы находятся в равновесии друг с другом. Например, при температурах и давлениях, соответствующих точкам кривой ТС, вода и ее пар находятся в равновесии. Это и есть кривая давления пара воды. В точке Х на этой кривой жидкая вода и пар находятся в равновесии при температуре 373 К (100°С) и давлении 1 атм (101,325 кПа); точка Х представляет собой точку кипения воды при давлении 1 атм.
Кривая АТ является кривой давления пара льда; такую кривую обычно называют кривой сублимации.
Кривая ВТ представляет собой кривую плавления. Она показывает, как давление влияет на температуру плавления льда: если давление возрастает, температура плавления немного уменьшается. Такая зависимость температуры плавления от давления встречается редко. Обычно возрастание давления благоприятствует образованию твердого вещества. В случае воды повышение давления приводит к разрушению водородных связей, которые в кристалле льда связывают между собой молекулы воды, заставляя их образовывать громоздкую структуру. В результате разрушения водородных связей происходит образование более плотной жидкой фазы.
В точке Y на кривой ВТ лед находится в равновесии с водой при температуре 273 К (0°С) и давлении 1 атм. Она представляет собой точку замерзания воды при давлении 1 атм.
Кривая SТ указывает давление пара воды при температурах ниже ее точки замерзания. Поскольку вода в нормальных условиях не существует в виде жидкости при температурах ниже ее точки замерзания, каждая точка на этой кривой соответствует воде, находящейся в метастабильном состоянии. Это означает, что при соответствующих температуре и давлении вода находится не в своем наиболее устойчивом (стабильном) состоянии. Явление, которое соответствует существованию воды в метастабильном состоянии, описываемом точками этой кривой, называется переохлаждением.
На фазовой диаграмме имеются две точки, представляющие особый интерес. Прежде всего, отметим, что кривая давления пара воды заканчивается точкой С. Она называется критической точкой воды. При температурах и давлениях выше этой точки пары воды не могут быть превращены в жидкую воду никаким повышением давления. Другими словами, выше этой точки паровая и жидкая формы воды перестают быть различимыми. Критическая температура воды равна 647 К, а критическое давление составляет 220 атм.
Точка Т фазовой диаграммы называется тройной точкой. В этой точке лед, жидкая вода и пары воды находятся в равновесии друг с другом. Этой точке соответствуют температура 273,16 К и давление 6,03 10-3 атм. Лишь при указанных значениях температуры и давления все три фазы воды могут существовать вместе, находясь в равновесии друг с другом.
33.
Число степеней свободы – число параметров состояния системы, которые могут быть одновременно произвольно изменены в некоторых пределах без изменения числа и природы фаз в системе.
Число степеней свободы гетерогенной термодинамической системы, находящейся в состоянии фазового равновесия, определяется правилом фаз, сформулированным Дж. Гиббсом:
Число степеней свободы равновесной термодинамической системы С равно числу независимых компонентов системы К минус число фаз Ф плюс число внешних факторов, влияющих на равновесие.
34.
Правило фаз (или правило фаз Гиббса) — соотношение, связывающее число веществ (компонентов), фаз и степеней свободы в гетерогенной системе.
Правило фаз записывается следующим образом:
Если в равновесной системе присутствует Ф фаз и К компонентов, то число степеней свободы С определяется уравнением С = К + 2 – Ф
Или использовать определение выше
Правило фаз помогает ответить на интересующий экспериментатора вопрос, напрмер, об условии сохранении раствора ненасыщенным, т.е. определить, можно ли независимо изменять температуру и концентрацию так, чтобы число фаз оставалось постоянным. Например, в случае с раствором хлорида калия система содержит 2 компонента (KOH и H2O), две фазы (раствор и пар), и, соответственно, имеет 2 степени свободы (С=К+2-Ф = 2+2-2=2). Это означает, что можно независимо изменять в некоторых пределах и температуру, и концентрацию соли так, что раствор хлорида калия остается ненасыщенным.
35-41 ???.
ДИАГРАММА СОСТОЯНИЯ (фазовая диаграмма), графич. изображение всех возможных состояний термодинамич. системы в пространстве осн. параметров состояния т-ры Т, давления р и состава х (обычно выражаемого молярными или массовыми долями компонентов). Для сложных систем, состоящих из многих фаз и компонентов, построение диаграммы состояния является единственным методом, позволяющим на практике установить, сколько фаз и какие конкретно фазы образуют систему при данных значениях параметров состояния.
Диаграмма состояния двухкомпонентной (двойной) системы в общей случае представляет собой пространственную фигуру, имеющую три координатные оси: концентраций одного из компонентов, температур и давлений. Если система конденсирована, то ее равновесное состояние можно изобразить более простой плоской диаграммой, являющейся изобарным сечением пространственной фигуры (например, при атмосферном давлении).
Такую диаграмму называет изобарной диаграммой равновесного состояния конденсированной системы. Однако, в литературе вместо этого слишком длинного термина обычно применяют более краткие названия: диаграмма состояния, фазовая диаграмма, диаграмма плавкости и др. Ограничимся рассмотрением конденсированных двойных систем с образованием химических соединений. Диаграмма состояния системы, где компоненты А и В образуют соединение АВ, приведена на рис. 2.1. В этом случае диаграмма состояния разбивается ординатой соединения на две самостоятельные системы эвтектического типа: А−АВ и АВ−В. Соединений может быть и больше. В соответствии с их числом диаграмма состояния в целом разбивается на (n+1) простых двойных систем, где n − число образующихся химических соединений. Всистеме Cu−Mg, например, кристаллизуются два соединения Cu2Mg и Mg2Cu, которым отвечают две дистектики на диаграмме состояния (рис. 2.2).
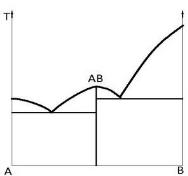
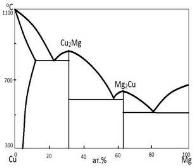
Рис. 2.1. Диаграмма состояния двойной конденсированной системы с образованием прочного химического соединения и в отсутствие твердых растворов |
Рис. 2.2. Диаграмма состояния системы Сu - Mg |
Химическое соединение (рис. 2.1), плавящееся без разложения, называют конгруэнтно плавящимся. Возможно образование химического соединения по перитектической реакции между твердой и жидкими фазами (рис. 2.3) В + ж ↔АВ.
Такое соединение называют инконгруэнтно плавящимся (плавящимся с разложением).
В системе с образованием химического соединения нередко происходит образование эвтектик между твердыми растворами на основе чистых компонентов и твердым раствором на основе химического соединения (рис. 2.4). Образование твердых растворов изменяет характер равновесия в системе и оказывает решающее влияние на эффективность синтетических реакций − на выход и чистоту получаемых соединений.
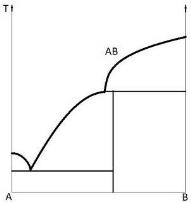
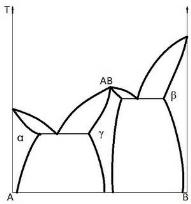
Рис. 2.3. Диаграмма состояния двойной конденсированной системы с образованием инконгруэнтно плавящегося (растворяющегося) химического соединения и в отсутствие твердых растворов |
Рис. 2.4. Диаграмма состояния двойной конденсированной системы с образованием химического соединения и твердых растворов: α и β-поля твердых растворов на основе компонентов А и В соответственно, γ -поле твердого раствора на основе химического соединения АВ |
36. Бинарный сплав с полной растворимостью компонентов в жидком состоянии и полной нерастворимостью в твердом (простая эвтектика)
37. Бинарные сплавы с полной растворимостью компонентов в жидком и твердом состоянии.
38. Бинарный сплав с полной растворимостью в жидком состоянии и ограниченной в твердой (диаграмма с эвтектикой и перитектикой).
39. Диаграммы с полной растворимостью компонентов в жидком состоянии и наличием твердых химических соединений, плавящихся инконгруентно.
40. Диаграммы с полной растворимостью компонентов в жидком состоянии и наличием твердых химических соединений, плавящихся конгруентно.
41. Бинарные сплавы с расслоением в жидком или твердом состоянии.
42. Диаграммы состояния тройных водно-солевых систем.
Тройная система представляет несравненно большие возможности для протекания химических реакций. Для примера рассмотрим тройные системы, содержащие две соли с общим анионом и воду, т.е. системы состава АХ−ВХ−Н2О. Для системы, состоящей из трех компонентов, число независимых параметров, определяющих ее состояние, равно четы-
рем: две концентрации, температура и давление пара. Для изображения состояния такой системы по четырем параметрам требовалось бы построение четырехмерной диаграммы. Практически ограничиваются изображением трехмерных пространственных диаграмм, не отображающих давление пара, а чаще − двухмерных плоскостных диаграмм, не отображающих и температуры (изотермы).
Диаграмма состояния системы, две соли которой взаимодействуют с образованием соединения, не разлагающегося при растворении в воде, имеет вид, представленный на рис.2.5.
На этой диаграмме область E1CE2 отвечает кристаллизации образовавшегося соединения С. Состав соединения определяется отношением отрезков АХ−С:С−BX, образующихся при пересечении лучей E1K1 и E2K2 в точке С, лежащей на стороне АХ−ВХ треугольника составов. Соединение С имеет свою кривую растворимости или изотерму растворимости E1E2. Так как луч соединения H2O−С пересекает кривую растворимости соединения Е1Е2, то соединение при растворении в воде не разлагается т. е. является конгруэнтно растворимым. Когда для синтеза применяют метод высаливания, то образование соединения происходит следующим образом. При добавлении к насыщенному раствору соли АХ (T=const) небольшими порциями кристаллов соли ВХ при интенсивном перемешивании
раствора будет происходить растворение соли ВХ и выделение кристаллов соли АХ.
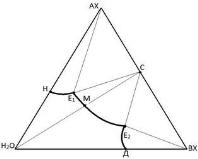
Рис. 2.5. Диаграмма состояния
тройной водно-солевой системы с
образованием безводного конгру-
энтно растворимого химического
соединения
Точка Н начнет перемещаться по кривой растворимости соли АХ к эвтонической точке E1. В растворе будет протекать реакция образования соединения С: АХ + ВХ = С и его ненасыщенного раствора. По мере добавления все новых количеств соли ВХ в растворе образуются все большие количества соединения С, увеличивающие его концентрацию в растворе. Одновременно из раствора будет выделяться часть соли АХ, не вступившей в реакцию с солью ВХ. Когда состав раствора достигнет эвтонической точки Е1, он окажется насыщенным по соединению С и поэтому дальнейшее добавление соли ВХ вызовет одновременное выделение кристаллов соединения С и кристаллов соли АХ. Последующее добавление соли ВХ к раствору вызовет уже растворение кристаллов соли АХ и выделение новых количеств кристаллов соединения С. Состав раствора, отвечающий координатам точки E1, не будет изменяться до тех пор, пока в результате непрерывного добавления соли ВХ все кристаллы соли АХ из осадка не перейдут в раствор с образованием соединения С. Дальнейшее прибавление соли ВХ к раствору приведет к образованию новых количеств соединения С уже за счет уменьшения концентрации соли АХ в растворе, поэтому состав раствора начнет изменяться по кривой растворимости E1–E2 соединения С, вызывая дальнейшую кристаллизацию соединения. Выделение кристаллов соединения С прекратится, как только состав раствора станет отвечать составу, определяемому эвтонической точкой E2. С этого момента все добавляемое количество соли ВХ будет переходить в осадок, загрязняя выделившиеся прежде кристаллы соединения С.
Таким образом, синтез соединения С методом высаливания следует производить с использованием раствора состава точки Ф1 и соли ВХ, добавление которой к этому раствору надо заканчивать после получения раствора состава, отвечающего точке Ф4 лежащей вблизи эвтонической точки E2.
Синтез соединения С возможен также и с использованием насыщенного раствора соли АХ (точка H) путем добавления к последнему соли ВХ, как это было описано выше. Однако, в этом случае возрастет длительность операций растворения кристаллов соли АХ и кристаллизации соединения С, увеличится и вероятность захвата выделяющимися кристаллами соединения С кристаллов выпадающей в осадок соли АХ и раствора.
Синтез соединения можно осуществить и обратным путем, добавлением к насыщенному раствору соли ВХ (точка Д) кристаллов соли АХ.
Наконец, синтез соединения С возможен при помощи метода изотермического испарения, удалением при постоянной температуре растворителя (воды). В этом случае используют растворы, близкие по составу к точкам, лежащим между точками Ф1 и М. С уменьшением количества воды в системе точка Ф1 сначала совпадает с точкой М, и раствор станет насыщенным по соединению С, и начнется кристаллизация соединения. Кристаллизация
будет продолжаться до полного, при этом состав раствора не изменяется, точка М перемещается по лучу соединения до точки С.
Если же подвергнуть изотермическому упариванию раствор состава точки Ф3, то вначале раствор станет насыщенным (точка Ф2) и соединение С станет выделяться в виде кристаллов. Кристаллизация будет продолжаться до тех пор, пока раствор не станет эвтоническим (точка E2) . В эвтонической точке будет выделяться механическая смесь кристаллов соединения С и кристаллов соли ВХ. Поэтому удаление растворителя следует прекратить еще до достижения точки E2.
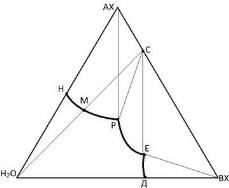
Рис. 2.6. Диаграмма состояния тройной
водно-солевой системы с образованием
безводного инконгруэнтно растворимого
химического соединения
Если образующееся в результате взаимодействия двух солей АХ и ВХ соединение С разлагается при растворении его в воде, то на диаграмме (рис 2.6) луч соединения(H2O–С) пересекает не свою кривую растворимости РЕ, а кривую растворимости либо соли АХ, либо соли ВХ. Соединение, разлагающееся при растворении в чистом растворителе, называется инконгруэнтно растворимым. В приведенном на рис. 2.6 случае соединение С будет разлагаться также и в насыщенных растворах соли АХ. Точка Р на диаграмме называется переходной точкой. В растворе состава точки Р соединение не разлагается, так как эта точка принадлежит к кривой растворимости соединения. В точке Р в фазовом
равновесии будут находиться две твердые фазы (АХ и С) и жидкая фаза, раствор состава точки Р.
Для синтеза инконгруэнтно растворимого соединения к насыщенному раствору соля АХ (точка Н) добавляют при интенсивном перемешивании соль ВХ. Вначале соль ВХ будет переходить в раствор, а соответствующее количество соли АХ выделяться вследствие уменьшения ее растворимости. Состав раствора будет изменяться по кривой растворимости соли АХ от точки Н к точке Р, в нем будет повышаться концентрация соединения
С. В переходной точке Р начнется кристаллизация соединения С, образуется механическая смесь кристаллов соединения и соли АХ. Дальнейшее добавление соли ВХ вызовет растворение кристаллов АХ, которое будет продолжаться до тех пор, пока все они
не перейдут в раствор, состав которого до этого момента остается постоянным, отвечающим координатам точки Р. После растворения последнего кристалла состав насыщенного раствора начнет с добавлением соли ВХ изменяться по кривой растворимости соединения С от точки Р к точке Е, раствор будет становиться все беднее и беднее по содержанию соли АХ и богаче по содержанию соединения С, непрерывно выделяющегося из раствора в виде
кристаллов. Когда состав раствора достигнет точки Е, дальнейшее прибавление соли ВХ уже не вызовет кристаллизации соединения С, так как все находившееся в растворе количество соли АХ окажется израсходованным на образование соединения. В
точке Е в растворении будут находиться три фазы: кристаллы соли ВХ, соединения С и раствор состава точки Е. Поэтому добавление соли ВХ прекращают до достижения точки Е.
Синтезируемое соединение может кристаллизоваться как в безводной, так и в гидратированной форме. На рис. 2.7 представлена диаграмма состояния системы, две соли которой при взаимодействии образуют конгруэнтно растворимое соединение
С∙nH2O (кристаллогидрат). Синтез таких соединений проводят, руководствуясь диаграммой состояния системы (рис.2.7) и рекомендациями, изложенными выше (для безводного конгруэнтно растворимого соединения).
I – поле ненасыщенных растворов; 2 – поле кристаллизации безводной соли АХ; 3 – поле кристаллизации соединения СÆnН2О; 4 – поле кристаллизации соли ВХ, содержащей в своем составе молекулы растворителя; 5 – поле кристаллизации солей АХ и CÆnН2О; 6 – поле кристаллизации C∙nН2О и ВХ∙mН2О; 7 – поле, содержащее смесь кристаллов CÆnH2O,
BXÆmH2O и ВХ; 8 – поле, содержащее смесь кристаллов АX, BХ и СÆnH2O
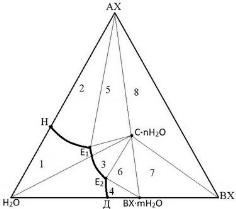
Рис. 2.7. Диаграмма состояния системы с образованием конгруэнтно растворимого соединения, содержащегов своем составе молекулы растворителя:
43.
Соконденсация из газовой фазы
Химическое осаждение из газовой фазы впервые было использовано для синтеза сапфира из фторида алюминия и воды, для получения металлических покрытий путем разложения летучего карбонила никеля и гексахлорида вольфрама. Начиная с 60-х годов XX века, химическое осаждение из газовой фазы находит широкое практическое применение в планарной технологии полупроводниковых приборов, для получения тугоплавких и обладающих особыми свойствами соединений, используемых во многих отраслях техники.
Основными достоинствами метода осаждения из газовой фазы по сравнению с традиционными являются:
– низкие температуры получения тугоплавких веществ,
– высокие скорости осаждения и возможность ее регулирования,
– возможность регулирования формы и структуры осадков,
– высокая чистота получаемых осадков,
– малое количество отходов и возможность полной утилизации ценных компонентов,
– определенная универсальность метода.
Тугоплавкие соединения, например оксиды, карбиды, нитриды, простые вещества (вольфрам, углерод), получают при температурах от 500 до 1500 CС, а с помощью некоторых методов активирования процесса – при температурах, близких к комнатной.
Скорости роста осадков могут достигать 1–5 мм/ч, это на один-два порядка выше достигаемых при электролизе расплавов. Изменение условий, например температуры, давления, концентрации реагентов, скорости газового потока и других, позволяет регулировать скорость роста осадков в широких пределах.
С помощью химического осаждения из газовой фазы удается получать осадки самой разной формы, зависящей от формы покрываемой поверхности (подложки). Газы, в отличие от жидких и тем более твердых веществ, обладают высокой подвижностью, легко достигают любой точки подложки, что и позволяет получать осадки в виде тонких пленок сложной геометрии, капилляров, труб, конусов, сфер, а в принципе – тел любой конфигурации, достаточно лишь придать эту конфигурацию подложке, обеспечить ее однородное нагревание и равномерное обтекание газовым потоком.
Этим методом выращивают монокристаллические волокна (так называемые усы), одномерные структуры – эпитаксиальные, поликристаллические или аморфные пленки и покрытия, трехмерные монокристаллы.
Многие реакции, используемые для химического осаждения из газовой фазы, протекают лишь при определенных условиях. Поэтому, если исходные реагенты и содержат примеси, то многие из этих примесей в осадок не переходят. Кроме того, хорошая летучесть реагентов позволяет проводить их глубокую очистку надежно освоенными методами.
Универсальность метода определяется широким набором получаемых веществ. Это бориды, карбиды, нитриды, силициды, фосфиды, арсениды, оксиды, халькогениды, металлы, неметаллы (алмаз, графит и др. простые вещества). Методом соконденсации из газовой фазы синтезируют стекла на основе диоксида кремния с добавками оксидов цинка, бериллия, бора, алюминия, титана, фосфора при 300–500 °С.
Для синтеза бинарных соединений используют как реакции обмена, так и окислительно-восстановительные реакции. Например, для получения оксидов широко применяется пирогидролиз галогенидов:
2AlF3(г) + 3H2O(г) →Al2O3↓ + 6HF(г);
SiF4(г) + 2H2O(г) → SiO2↓ + 4HF(г);
TiCl4(г) + 2H2O(г) → TiO2↓ + 4HCl (г);
SnCl4(г) + 2H2O(г) → SnO2↓ + 4HCl(г).
С кислородом легко взаимодействуют гидриды, карбонилы и другие вещества:
SiH4(г) + 2O2(г) → SiO2↓ +2H2O(г);
2Ni(CO)4(г) + 5O2(г) → 2NiO↓ + 8CO2(г);
SnCl4(г) + O2(г) → SnO2↓ + Cl2(г);
UF6 +3H2 + O2 → UO2↓ + 6HF(г).
Карбиды и нитриды образуются в результате взаимодействия галогенидов с метаном и аммиаком. Например:
SiCl4(г) + CH4(г) → SiC↓ + 4HCl(г);
ZrBr4(г) + CH4(г) → ZrC↓ + 4HBr(г);
AlBr3(г) + NH3(г) → AlN↓ + 3HBr(г);
2TiCl4(г) + 2NH3(г) → 2TiN↓ + 6HCl(г) + Cl2(г).
Для синтеза карбидов и нитридов используют и другие реакции:
SiO(г) + CO(г) → SiC↓ + O2(г);
ZrCl(г) + 0,5N2(г) + 2H2(г) → ZrN↓ + 4HCl(г).
Химическое осаждение – хаотический процесс, идущий при смешении конденсирующихся друг с другом мономеров при сравнительно высоких температурах. Молекулы мономеров реагируют между собой как на подложке, так и вне ее с образованием кристаллических зародышей. Температура вблизи них резко повышается из-за выделения теплоты кристаллизации. Это ускоряет процесс в отдельных точках реакционного пространства, где конденсируются все новые и новые молекулы. Теплоты выделяется больше, и температура повышается выше, концентрация реагирующих веществ беспорядочно и по-разному изменяется вблизи разных растущих кристаллов. Создаются условия формирования нескольких фаз. Например, при осаждении токопроводящей пленки диоксида олова гидролизом тетрахлорида олова зафиксировано образование шести фаз оксида олова.
По мере роста, увеличиваясь в размерах, кристаллы при ближаются друг к другу и смыкаются, образуя сравнительно толстый неупорядоченный слой твердого вещества, насыщенного различными дефектами. Поскольку образование эпитаксиальных пленок идет путем возникновения и слияния кристаллических зародышей, размеры которых заведомо превышают толщину монослоя, то, очевидно, не может быть и речи о получении методом эпитаксиального осаждения пленок точно заданной толщины, а следовательно, и о точном воспроизведения состава и строения многослойных эпитаксиальных пленок. Для решения этой проблемы разработан матричный синтез (метод молекулярной эпитаксии).
45. Матричный синтез
Матричный синтез - воспроизводимый синтез твердых веществ, осуществляемый путем химической сборки структурных единиц на соответствующих матрицах.
Метод химической сборки твердых веществ посредством молекулярного наслаивания открывает перспективы для направленного синтеза твердых веществ заданного состава и строения, определяющих комплекс необходимых свойств материалов.
В качестве примера укажем на некоторые практические вопросы, решаемые в настоящее время методом молекулярного наслаивания. Это наращивание материала, увеличение его массы; создание защитных оболочек на микрочастицах пигментов. Прямой выход матричный синтез дает в области сорбентов и катализаторов. Здесь идет речь о создании оптимальных катализаторов с регулировкой как по способу расположения активной компоненты в сложных катализаторах, так и до пористой структуры.
Решение методом молекулярного наслаивания задачи тонкой регулировки размеров пор сорбентов и возможность одновременного изменения химической природы поверхности путем нанесения различных слоев показывают, что можно приступить к конструированию и синтезу оптимальных сорбентов для соответствующих веществ. Проводя по определенной программе ряд актов химической сорбции не менее чем бифункциональных молекул то одних, то других веществ, химически конденсирующихся на подготовленной для этого поверхности твердого тела, удается монослой за монослоем осуществлять химическую сборку твердых веществ. Прецизионными измерениями было показано, что строение синтезированных веществ в точности отвечает запрограммированному.
Чередование в процессе молекулярного наслаивания реакций конденсации подложки то лишь с одним, то только с другим мономером исключает беспорядочную конденсацию их друг с другом на и вне подложки. Последняя служит матрицей для присоединения структурных единиц и образования на ней их монослоя, а не кристаллов. Подложка является в то же время термостатом, в котором обеспечивается синтез твердых продуктов, находящихся в некотором определенном энергетическом состоянии, зависящем при данных термодинамических условиях от состава и строения подложки, включая состав и строение принадлежащего ей набора функциональных групп.
От известных процессов химического осаждения сборка отличается тем, что позволяет получать твердые вещества не только периодического, но я регулярного непериодического строения. От кристаллизации этот процесс отличается тем, что позволяет осуществлять фазовое превращение, минуя высокие потенциальные барьеры, обусловленные зародышеобразованием и необходимостью разрыва особо прочных межатомных связей C-C, Si-О, В-N и т. п. Благодаря этому химическая сборка связана с термодинамическими условиями не обычного фазового перехода, а с условиями протекания химических реакций и потому осуществляется при сравнительно низких температурах и давлении. Синтезируемое этим методом твердое вещество может иметь любую из бесчисленного множества структур, существующих при метастабильном состоянии вещества, и притом именно ту, которая необходима.
В воспроизводимом синтезе твердых веществ матрицу используют для оборки структурных единиц в монослои – двухмерные структуры, а затем и для сборки системы монослоев – трехмерной структуры. Если первая операция была подготовлена теорией и практикой сорбции, то последняя может исходить из результатов изучения эпитаксии. Установлено, что структура
