
- •8) Химические свойства алкенов. Реакции элетрофильного …..
- •1.Присоединение водорода
- •16. Химические свойства альдегидов и кетонов. Строение карбонильной группы, ее полярность, поляризуемость.Кето-енольная таутомерия в ряду жирно-ароматических и алифатических альдегидов
- •2.Присоединение водорода
- •24. Диазосоединения.Строение ароматических диазосоединений. Основные методы синтеза алифатических и ароматических диазосоединений. Синтезы с участием ароматических
- •32. Как можно разделить смесь этана, этилена и ацетилена.?
- •39. Какая реакция, характерная для альдегидов, не свойственна глюкозе?
- •50. C2h6→b→c3h6→c→ацетон
2.Присоединение водорода
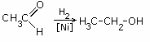
II.Реакция замещения карбонильного кислорода
1.Взаимодействие с гидроксиламином
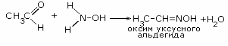
2.Взаимодействие с пятихлористого фосфора

Существует три основных типа реакций кетонов. Первый связан с нуклеофильной атакой по атому углерода карбонильной группы. Например, взаимодействие кетонов с цианид-анионом или металлорганическими соединениями. К этому же типу (нуклеофильного присоединения) относится взаимодействие карбонильной группы со спиртами, приводящее к ацеталям и полуацеталям. Взаимодействие со спиртами:
CH3COCH3 + 2C2H5OH → C2H5—O—C(CH3)2—O—C2H5 + H2O
c реактивами Гриньяра: C2H5—C(O)—C2H5 + C2H5MgI → (C2H5)3—COMgI → (C2H5)3—COH, третичный спирт. Реакции с альдегидами, и особенно с метаналем идут заметно активнее, при этом с альдегидами образуются вторичные спирты, а с метаналем — первичные. Также кетоны реагируют с азотистыми основаниями, например, с аммиаком и первичными аминами с образованием иминов:
CH3—C(O)—CH3 + CH3NH2 → CH3—C(N—CH3)—CH3 + H2O. Второй тип реакций — депротонирование бета-углеродного атома, по отношению к карбонильной группе. Образующийся карбанион стабилизирован за счёт сопряжения с карбонильной группой, лёгкость удаления протона возрастает, поэтому карбонильные соединения являются сравнительно сильными С—Н кислотами. Третий — координация электрофилов по неподелённой паре атома кислорода, например, таких кислот Льюиса, как AlCl3.К отдельному типу реакций можно отнести восстановление кетонов — восстановление по Лейкарту с выходами близкими к количественным
Свойства
альдегидов и кетонов определяются
строением карбонильной группы >C=O.
Атомы углерода и кислорода в карбонильной
группе находятся в состоянии
sp2-гибридизации. Углерод своими
sp2-гибридными орбиталями образует 3
σ-связи (одна из них – связь С–О), которые
располагаются в одной плоскости под
углом около 120° друг к другу. Одна из
трех sp2-орбиталей кислорода участвует
в σ-связи С–О, две другие содержат
неподеленнные электронные пары.

π-Связь
образована р-электронами атомов углерода
и кислорода.
Связь
С=О сильно полярна. Ее дипольный момент
(2,6-2,8D) значительно выше, чем у связи С–О
в спиртах (0,70D). Электроны кратной связи
С=О, в особенности более подвижные
π-электроны, смещены к электроотрицательному
атому кислорода, что приводит к появлению
на нем частичного отрицательного заряда.
Карбонильный углерод приобретает
частичный положительный заряд

Кето-енольная таутомерия. Водород в a -положении к карбонильной группе обладает кислотными свойствами, так как образующийся при его отщеплении анион стабилизируется за счет резонанса.

Результатом протонной подвижности атома водорода в a -положении является способность карбонильных соединений к образованию енольных форм за счет миграции протона из a -положения к атому кислорода карбонильной группы.

Кетон и енол являются таутомерами. Таутомеры – это изомеры, способные быстро и обратимо превращаться друг в друга за счет миграции какой-либо группы (в данном случае – протона). Равновесие между кетоном и енолом называют кето-енольной таутомерией. Процесс енолизации катализируется кислотами и основаниями. Енолизация под действием основания может быть представлена следующей схемой:
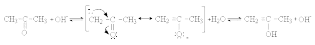
Большинство карбонильных соединений существуют преимущественно в кетонной форме. Содержание енольной формы возрастает с увеличением кислотности карбонильного соединения, а также в случае дополнительной стабилизации енольной формы за счет водородной связи или за счет сопряжения. Если соединение в енольной форме представляет собой сопряженную систему с высокой энергией стабилизации, то енольная форма преобладает. Например, фенол существует только в енольной форме. Енолизация и образование енолят-анионов являются первыми стадиями реакций карбонильных соединений, протекающих по a -углеродному атому. Важнейшими из них яв-ся галогенирование и альдольно-кротоновая конденсация. Альдегиды и кетоны легко вступают в реакцию с галогенами (Cl2, Br2, I2) с образованием исключительноa -галогенпроизводных.
 Если карбонильное
соединение содержит несколько a -водородных
атомов, то замещение каждого последующего
происходит быстрее, чем предыдущего,
вследствие увеличения их кислотности
под действием электроноакцепторного
влияния галогена. В щелочной среде
ацетальдегид и метилкетоны дают
тригалогенпроизводные, которые затем
расщеплятся под действием избытка
щелочи с образованием тригалогенметанов
(галоформная
реакция).
Если карбонильное
соединение содержит несколько a -водородных
атомов, то замещение каждого последующего
происходит быстрее, чем предыдущего,
вследствие увеличения их кислотности
под действием электроноакцепторного
влияния галогена. В щелочной среде
ацетальдегид и метилкетоны дают
тригалогенпроизводные, которые затем
расщеплятся под действием избытка
щелочи с образованием тригалогенметанов
(галоформная
реакция).
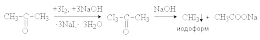 Иодоформ выпадает
из реакционной смеси в виде бледно-желтого
кристаллического осадка с характерным
запахом. Иодоформную реакцию используют
в аналитических целях для обнаружения
соединений типа СH3-CO-R,
в том числе в клинических лабораториях
для диагностики сахарного диабета.
Иодоформ выпадает
из реакционной смеси в виде бледно-желтого
кристаллического осадка с характерным
запахом. Иодоформную реакцию используют
в аналитических целях для обнаружения
соединений типа СH3-CO-R,
в том числе в клинических лабораториях
для диагностики сахарного диабета.
