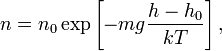- •1) Материя, объекты исследования в физике, методы исследования. Закон.
- •3) Ускорение при криволинейном поступательном движении: нормальное, тангенциальное и полное.
- •4) Кинематика вращательного движения.
- •5) Связь характеристик кинематики поступательного движения с характеристиками кинематики вращательного движения.
- •6. Кинематика колебательного движения: смещение, скорость, ускорение.
- •7) Законы Ньютона. Границы применимости законов Ньютона.
- •8) Силы: вес, трение, сила упругости.
- •9) Закон сохранения импульса, проекции импульса**
- •10)Кинетическая и потенциальная энергии.
- •11)Полная механическая энергия и закон ее сохранения.** Применение законов сохранения к ударам.
- •12. Границы движения. Потенциальная яма, потенциальный барьер.
- •13. Момент инерции точки относительно оси, момент инерции тела относительно оси вращения. Теорема Штейнера.***
- •15) Момент силы относительно точки, относительно оси вращения.***
- •16) *Основной закон динамики вращательного движения.***
- •17) * Момент импульса. Закон сохранения момента импульса.***
- •18) Гравитационное поле Земли и его характеристики
- •19) Постулаты частной теории относительности Эйнштейна. Преобразования Лоренца и следствия из них.
- •1. Первый постулат - принцип относительности (по)
- •2. Второй постулат – о предельной скорости распространения физических сигналов:
- •20) Векторная диаграмма колебательного движения и ее применение при сложении одинаково направленных колебаний.( навряд ли правильно)
- •22) Затухающие колебания. Уравнение, коэффициент затухания, логарифмический декремент затухания.
- •23) Вынужденные колебания, резонанс
- •24) Термодинамическая система (тс), методы исследования, идеальный газ, газовые законы.
- •25) Термодинамические параметры, уравнение Менделеева- Клапейрона.
- •26) Внутренняя энергия тс, изменение внутренней энергии.
- •27) Работа при изменении объема.
- •28) Теплоемкость (удельная, молярная, при постоянном объеме, при постоянном давлении).
- •29) Первое начало термодинамики и его применение к изопроцессам.****
- •31)Энтропия. Второе начало термодинамики.
- •32. * Вывод основного уравнения молекулярно-кинетической теории газов***(убейтесь сразу, если попадётся на экзамене)(слямзено с википедии, так что, если что упустил, проверьте)
- •33. Максвелловское распределение молекул по скоростям. Наиболее вероятная скорость. Зш распределения энергии по степеням свободы.
- •34)Распределение Больцмана. Барометрическая формула.
- •35) Жидкость. Поверхностное натяжение.
- •36) Капиллярные явления. Давление Лапласа
- •37. Явления переноса.*(не уверен, что пункты 1,2 и 3 нужны, но это так, на всякий случай).
- •38.Электрический заряд. Дискретность заряда. Закон сохранения электрического заряда. Закон Кулона.
- •39.Электростатическое поле. Напряженность электростатического поля. Принцип суперпозиции электростатических полей. Поле диполя.
- •40.Поток вектора напряженности электростатического поля.**Теорема Остроградского-Гаусса для электростатического поля в вакууме.
- •41.***Применение теоремы о-г к расчету некоторых электростатических полей в вакууме (точечного заряда, бесконечных плоскости и нити, сферы). Равномерно заряженная бесконечная плоскость
- •Бесконечная равномерно заряженная нить
- •42**Циркуляция вектора напряженности электростатического поля.
- •43.Потенциал электростатического поля. Принцип суперпозиции потенциала.
- •44.****Напряженность как градиент потенциала. Эквипотенциальные поверхности.
- •45.Нахождение разности потенциалов по напряженности поля для плоскости и нити.
- •46.**Типы диэлектриков. Поляризация диэлектриков. Поляризованность Сегнетоэлектрики.
- •47. Условия на границе раздела двух диэлектрических сред.
- •48.Проводники в электростатическом поле.
- •49.Электрическая емкость уединенного проводника. Конденсаторы.
- •50.**Энергия системы зарядов, уединенного проводника, конденсатора. Энергия электростатического поля.
- •51. Электрический ток. Сила и плотность тока. Сторонние силы. Электродвижущая сила и напряжение.
- •52. *Закон Ома для однородного, неоднородного участков цепи и замкнутой цепи.. Сопротивление.
- •53. *Работа и мощность тока. Закон Джоуля- Ленца.
- •54. ***Правила Кирхгофа для разветвленных цепей.
- •57. Закон Ампера. Взаимодействие токов.
- •58. Магнитное поле движущегося заряда.
- •59. *Сила Лоренца. Движение заряженной частицы в магнитном поле.
- •60. **Эффект Холла.
- •62. ***Явление электромагнитной индукции и самоиндукции.***Закон Фарадея, ****правило Ленца. (Трофимова, стр. 222-223)
- •63. Вращение рамки в магнитном поле
- •64. Индуктивность контура. *Токи при замыкании и размыкании.
- •65. * Взаимная индукция. Трансформаторы.
- •66. Энергия магнитного поля.
- •67.*Магнитные моменты электронов и атомов.
- •69. Намагниченность. Магнитное поле в веществе.
- •70. Ферромагнетики и их свойства.
- •71. ***Уравнения Максвелла для электромагнитного поля в интегральной форме.(интегралы заполняются только внизу. Вверху нет ничего)
- •72. ****Электромагнитный колебательный контур.
- •73. **Переменный ток. Векторная диаграмма.
- •74. **Резонанс токов.
- •75. **Резонанс напряжений.
- •76. Мощность, выделяемая в цепи переменного тока.
31)Энтропия. Второе начало термодинамики.
Энтропия – это количественная характеристика беспорядка в системе.
Второе начало термодинамики:
1.Любой необратимый процесс в замкнутой системе происходит так, что энтропия возрастает.
2.Невозможен круговой процесс, в котором теплота от менее нагретого тела передаётся более нагретому телу.
32. * Вывод основного уравнения молекулярно-кинетической теории газов***(убейтесь сразу, если попадётся на экзамене)(слямзено с википедии, так что, если что упустил, проверьте)
Пусть
имеется кубический сосуд с ребром
длиной ![]() и
одна частица массой
в
нём.
и
одна частица массой
в
нём.
Обозначим
скорость движения ![]() ,
тогда перед столкновением со стенкой
сосуда импульс частицы
равен ,
,
тогда перед столкновением со стенкой
сосуда импульс частицы
равен ,![]() ,
а после —
,
а после — ![]() ,
поэтому стенке передается импульс
,
поэтому стенке передается импульс ![]() .
Время, через которое частица сталкивается
с одной и той же стенкой, равно
.
Время, через которое частица сталкивается
с одной и той же стенкой, равно ![]()
.
Отсюда следует:
,
![]()
Так
как давление![]() ,,
следовательно сила
,,
следовательно сила ![]()
Подставив,
получим: ,![]()
Преобразовав: ,![]()
Так
как рассматривается кубический сосуд,
то ![]()
Отсюда:
.![]()
Соответственно![]() , и
, и![]() .
.
Таким
образом, для большого числа частиц верно
следующее: .![]() ,
аналогично для осей y и z.
,
аналогично для осей y и z.
Поскольку ,![]() ,
то ,
,
то ,![]() .
Это следует из того, что все направления
движения молекул в
хаотичной среде равновероятны.
.
Это следует из того, что все направления
движения молекул в
хаотичной среде равновероятны.
Отсюда ,![]()
или ![]() .
.
Пусть ,![]() —
среднее значение кинетической энергии
всех молекул, тогда:
—
среднее значение кинетической энергии
всех молекул, тогда:
,![]() ,
откуда ,
,
откуда ,![]() .
.
Для
одного моля выражение примет вид ,![]()
33. Максвелловское распределение молекул по скоростям. Наиболее вероятная скорость. Зш распределения энергии по степеням свободы.
Закон распределения молекул по скоростям Максвелла описывает стационарное распределение молекул однородного одноатомного идеального газа по скоростям в условиях термодинамического равновесия и отсутствия внешнего силового поля. Максвелловское распределение молекул по скоростям устанавливается в результате взаимных столкновений между молекулами при их хаотическом тепловом движении. Если в соответствующей формуле заменить скорость молекулы на ее кинетическую энергию, тогда мы вместо распределения по скоростям получим распределение по энергиям.
Наиболее
вероятная скорость, ,![]() —
вероятность обладания которой любой
молекулой системы максимальна, и которая
соответствует максимальному значению ,
—
вероятность обладания которой любой
молекулой системы максимальна, и которая
соответствует максимальному значению ,![]() .
Чтобы найти её, необходимо вычислить
.
Чтобы найти её, необходимо вычислить ![]() ,
приравнять её нулю и решить относительно ,
,
приравнять её нулю и решить относительно ,![]() :
:
![]()
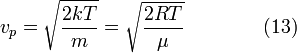
Закон
равномерного распределения энергии по
степеням свободы молекул можно
сформулировать следующим образом:
статистически в среднем на каждую
степень свободы молекул приходится
одинаковая энергия. Поступательное
движение молекул характеризуется
средней кинетической энергией, равной ,![]() .
Так как поступательному движению
соответствует 3 степени свободы, то в
среднем на одну степень свободы движения
молекул приходится энергия
.
Так как поступательному движению
соответствует 3 степени свободы, то в
среднем на одну степень свободы движения
молекул приходится энергия
![]()
В
однородном газе, молекулы которого
имеют любое число степеней свободы i,
каждая молекула в среднем обладает
энергией движения, равной
![]()
34)Распределение Больцмана. Барометрическая формула.
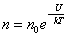 – это
закон распределения частиц по потенциальным
энергиям – распределение Больцмана. Здесь n0 –
число молекул в единице объёма там,
где U =
0.
– это
закон распределения частиц по потенциальным
энергиям – распределение Больцмана. Здесь n0 –
число молекул в единице объёма там,
где U =
0.
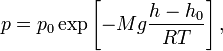 барометрическая
формула, где
барометрическая
формула, где ![]() —
давление газа в слое,
расположенном на высоте
—
давление газа в слое,
расположенном на высоте ![]() ,
, ![]() —
давление на нулевом уровне (
—
давление на нулевом уровне (![]() ),
), ![]() — молярная
масса газа,
— молярная
масса газа, ![]() — газовая
постоянная,
— газовая
постоянная, ![]() — абсолютная
температура.
Из барометрической формулы следует,
что концентрация молекул
— абсолютная
температура.
Из барометрической формулы следует,
что концентрация молекул ![]() (или
плотность газа) убывает с высотой по
тому же закону:
(или
плотность газа) убывает с высотой по
тому же закону: