
- •1) Материя, объекты исследования в физике, методы исследования. Закон.
- •3) Ускорение при криволинейном поступательном движении: нормальное, тангенциальное и полное.
- •4) Кинематика вращательного движения.
- •5) Связь характеристик кинематики поступательного движения с характеристиками кинематики вращательного движения.
- •6. Кинематика колебательного движения: смещение, скорость, ускорение.
- •7) Законы Ньютона. Границы применимости законов Ньютона.
- •8) Силы: вес, трение, сила упругости.
- •9) Закон сохранения импульса, проекции импульса**
- •10)Кинетическая и потенциальная энергии.
- •11)Полная механическая энергия и закон ее сохранения.** Применение законов сохранения к ударам.
- •12. Границы движения. Потенциальная яма, потенциальный барьер.
- •13. Момент инерции точки относительно оси, момент инерции тела относительно оси вращения. Теорема Штейнера.***
- •15) Момент силы относительно точки, относительно оси вращения.***
- •16) *Основной закон динамики вращательного движения.***
- •17) * Момент импульса. Закон сохранения момента импульса.***
- •18) Гравитационное поле Земли и его характеристики
- •19) Постулаты частной теории относительности Эйнштейна. Преобразования Лоренца и следствия из них.
- •1. Первый постулат - принцип относительности (по)
- •2. Второй постулат – о предельной скорости распространения физических сигналов:
- •20) Векторная диаграмма колебательного движения и ее применение при сложении одинаково направленных колебаний.( навряд ли правильно)
- •22) Затухающие колебания. Уравнение, коэффициент затухания, логарифмический декремент затухания.
- •23) Вынужденные колебания, резонанс
- •24) Термодинамическая система (тс), методы исследования, идеальный газ, газовые законы.
- •25) Термодинамические параметры, уравнение Менделеева- Клапейрона.
- •26) Внутренняя энергия тс, изменение внутренней энергии.
- •27) Работа при изменении объема.
- •28) Теплоемкость (удельная, молярная, при постоянном объеме, при постоянном давлении).
- •29) Первое начало термодинамики и его применение к изопроцессам.****
- •31)Энтропия. Второе начало термодинамики.
- •32. * Вывод основного уравнения молекулярно-кинетической теории газов***(убейтесь сразу, если попадётся на экзамене)(слямзено с википедии, так что, если что упустил, проверьте)
- •33. Максвелловское распределение молекул по скоростям. Наиболее вероятная скорость. Зш распределения энергии по степеням свободы.
- •34)Распределение Больцмана. Барометрическая формула.
- •35) Жидкость. Поверхностное натяжение.
- •36) Капиллярные явления. Давление Лапласа
- •37. Явления переноса.*(не уверен, что пункты 1,2 и 3 нужны, но это так, на всякий случай).
- •38.Электрический заряд. Дискретность заряда. Закон сохранения электрического заряда. Закон Кулона.
- •39.Электростатическое поле. Напряженность электростатического поля. Принцип суперпозиции электростатических полей. Поле диполя.
- •40.Поток вектора напряженности электростатического поля.**Теорема Остроградского-Гаусса для электростатического поля в вакууме.
- •41.***Применение теоремы о-г к расчету некоторых электростатических полей в вакууме (точечного заряда, бесконечных плоскости и нити, сферы). Равномерно заряженная бесконечная плоскость
- •Бесконечная равномерно заряженная нить
- •42**Циркуляция вектора напряженности электростатического поля.
- •43.Потенциал электростатического поля. Принцип суперпозиции потенциала.
- •44.****Напряженность как градиент потенциала. Эквипотенциальные поверхности.
- •45.Нахождение разности потенциалов по напряженности поля для плоскости и нити.
- •46.**Типы диэлектриков. Поляризация диэлектриков. Поляризованность Сегнетоэлектрики.
- •47. Условия на границе раздела двух диэлектрических сред.
- •48.Проводники в электростатическом поле.
- •49.Электрическая емкость уединенного проводника. Конденсаторы.
- •50.**Энергия системы зарядов, уединенного проводника, конденсатора. Энергия электростатического поля.
- •51. Электрический ток. Сила и плотность тока. Сторонние силы. Электродвижущая сила и напряжение.
- •52. *Закон Ома для однородного, неоднородного участков цепи и замкнутой цепи.. Сопротивление.
- •53. *Работа и мощность тока. Закон Джоуля- Ленца.
- •54. ***Правила Кирхгофа для разветвленных цепей.
- •57. Закон Ампера. Взаимодействие токов.
- •58. Магнитное поле движущегося заряда.
- •59. *Сила Лоренца. Движение заряженной частицы в магнитном поле.
- •60. **Эффект Холла.
- •62. ***Явление электромагнитной индукции и самоиндукции.***Закон Фарадея, ****правило Ленца. (Трофимова, стр. 222-223)
- •63. Вращение рамки в магнитном поле
- •64. Индуктивность контура. *Токи при замыкании и размыкании.
- •65. * Взаимная индукция. Трансформаторы.
- •66. Энергия магнитного поля.
- •67.*Магнитные моменты электронов и атомов.
- •69. Намагниченность. Магнитное поле в веществе.
- •70. Ферромагнетики и их свойства.
- •71. ***Уравнения Максвелла для электромагнитного поля в интегральной форме.(интегралы заполняются только внизу. Вверху нет ничего)
- •72. ****Электромагнитный колебательный контур.
- •73. **Переменный ток. Векторная диаграмма.
- •74. **Резонанс токов.
- •75. **Резонанс напряжений.
- •76. Мощность, выделяемая в цепи переменного тока.
25) Термодинамические параметры, уравнение Менделеева- Клапейрона.
Параметры состояния, термодинамические параметры — физические величины, характеризующие состояние термодинамической системы: температура, давление, удельный объём, намагниченность, электрическая поляризация и др. Различают экстенсивные параметры состояния, пропорциональные массе системы:
объём,
внутренняя энергия,
энтропия,
энтальпия,
энергия Гиббса,
энергия Гельмгольца (свободная энергия),
и интенсивные параметры состояния, не зависящие от массы системы:
давление,
температура,
концентрация,
магнитная индукция и др.
Не все параметры состояния независимы, так что равновесное состояние системы можно однозначно определить, установив значения ограниченного числа параметров состояния.
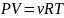 -уравнение
Менделеева – Клапейрона.
-уравнение
Менделеева – Клапейрона.
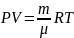 -
уравнение Менделеева
-
уравнение Менделеева
26) Внутренняя энергия тс, изменение внутренней энергии.
Внутренняя энергия термодинамической системы - включает в себя энергию микроскопического движения и взаимодействия частиц системы, а так же их внутримолекулярную и внутриядерную энергии.
Изменение внутренней энергии при переходе из одного состояния в другое будет всегда равно разности между ее значениями в конечном и начальном состояниях, независимо от пути, по которому совершался переход.
Внутреннюю энергию тела нельзя измерить напрямую. Можно определить только изменение внутренней энергии:
![]()
27) Работа при изменении объема.
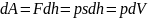 ,
,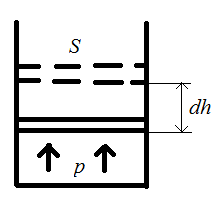
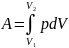 -
работа, совершаемая при конечных
изменениях объёма
-
работа, совершаемая при конечных
изменениях объёма
28) Теплоемкость (удельная, молярная, при постоянном объеме, при постоянном давлении).
Удельной теплоёмкостью называется теплоёмкость, отнесённая к единичному количеству вещества. Количество вещества может быть измерено в килограммах, кубических метрах и молях. В зависимости от того, к какой количественной единице относится теплоёмкость, различают массовую, объёмную и молярную теплоёмкость.
Молярная теплоёмкость (Сμ) — это количество теплоты, которое необходимо подвести к 1 молю вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на моль на кельвин (Дж/(моль·К)).
Теплоемкость при постоянном объеме равна изменению внутренней энергии газа при изменении температуры на 1 К
.![]()
Если газ нагревается при постоянном давлении, то согласно первому закону термодинамики
![]()
Где
![]()
Тогда теплоемкость газа при постоянном давлении
![]()
29) Первое начало термодинамики и его применение к изопроцессам.****
1.Изобарный процесс(постоянное давление):
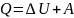


2.Изохорный процесс(постоянный объём):
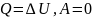
3.Изотермический процесс(постоянная температура):
Q=A

30. Адиабатный процесс. Уравнение Пуассона. (пи*дец какой-то, бл*ть!!!!!)
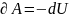
Работа газа при адиабатическом процессе идёт за счёт изменения его внутренней энергии, так как процесс идёт без теплообмена газа с окружающей средой.
1.pdV
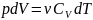 (1)
(1)
- в любой момент
Продифференцируем это уравнение:
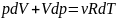 (2)
(2)
Разделим 2 на 1

Получим:
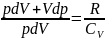 ?(проверьте знаки после
«=» )
?(проверьте знаки после
«=» )
Применим уравнение Майера:
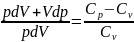
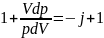
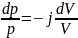
Интегрируем это уравнение:

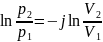
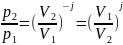
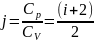
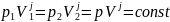
2.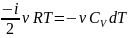
Уравнение Пауссона:

