
- •Лекция №3 Подгруппа галогенов
- •Нахождение в природе. История получения фтора
- •Получение фтора
- •Физические и химические свойства фтора
- •Химические свойства
- •Соединения фтора – фториды
- •Физические и химические свойства фтороводорода
- •Кислородные соединения фтора
- •Применение фтора и его соединений
- •Нахождение в природе. История получения хлора
- •Получение хлора
- •Физические и химические свойства хлора
- •Соединения хлора – хлориды
- •Физические и химические свойства хлороводорода
- •Сравнительная характеристика галогенводородов
- •Кислородные соединения хлора
- •Применение хлора и его соединений. Биологическая роль хлора
- •Бром, йод
- •Физические свойства брома и йода
- •Химические свойства брома и йода
- •Получение брома и йода
- •Соединения брома и йода
- •Кислородные соединения брома и йода
- •Пентаоксид йода
- •Соединения брома и йода с положительной степенью окисления
- •Применение брома и йода
Физические и химические свойства фтора
Фтор – светло-желтый газ с резким специфическим запахом. Фтор и его соединения ядовиты (за исключением CF4, SF6 и др.). Газообразный фтор растворим в жидком HF.
Химические свойства
1. Фтор – сильный окислитель. Он энергично и бурно реагирует с большинством простых веществ (за исключением N2, He, Ne, Ar) с образованием фторидов.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Фтор реагирует даже с благородными газами: криптон взаимодействует с фтором под действием электрического разряда. Ксенон горит в атмосфере фтора ярким пламенем с образованием фторидов.
![]()
При взаимодействии с любым простым веществом чаще всего фтор окисляет его до максимальной степени окисления.
2. Фтор со взрывом взаимодействует с водородом даже при низких температурах:
![]()
2. Энергично фтор взаимодействует с водой:
![]()
Кроме кислорода образуется также озон и дифторид кислорода OF2.
Прим. При растворении фтора в воде при температуре 0 ºС и ниже образуется фторноватистая кислота HOF – неустойчивая светло-желтая жидкость. При комнатной температуре фторноватистая кислота разлагается с образованием фтороводорода и кислорода.
3. Фтор вступает в реакцию с соединениями кремния (SiO2 – кварц):
![]()
Катализатором данной реакции является вода, с совершенно сухим кварцем (или стеклом) фтор не взаимодействует.
Фтор хранят в посуде из никеля и его сплавов, меди, алюминия, нержавеющей стали, потому что на поверхности металла под действием фтора образуется защитная пленка соответствующих фторидов металлов.
Соединения фтора – фториды
Степень окисления фтора равна –1. Фториды активных металлов – ионные фториды – это вещества с ионы типом химической связи. Ионные фториды – это кристаллические вещества, которые образуют ионные кристаллические решетки и обладают высокими температурами плавления и кипения. Например, NaF, CaF2.
Фториды неметаллов – ковалентные фториды – это вещества с ковалентной полярной связью. Ковалентные фториды – газы или жидкости, которые имеют кристаллические решетки молекулярного типа и обладают низкими температурами кипения и плавления. Например PF5, SF6.
Промежуточное положение между ионными и ковалентными фторидами занимают ионно-ковалентные фториды (ZnF2, MnF2, CoF2, NiF2). Это вещества c ковалентной полярной связью близкой к ионной.
Большинство фторидов мало растворимы в воде. Хорошо растворимы в воде фториды s-элементов I группы главной подгруппы (кроме LiF), а также AgF, HgF2, SnF2 и некоторые другие.
Фториды подразделяют на основные, кислотные и амфотерные. Ионные фториды являются основными соединениями, а ковалентные фториды – кислотными.
![]()
Основные фториды при гидролизе создают щелочную среду, а кислотные фториды кислую. Например:
![]()
![]()
Амфотерные фториды взаимодействуют как с основными, так и с кислотными фторидами с образованием комплексных фторидов:
![]()
![]()
Физические и химические свойства фтороводорода
Фтороводород HF
– бесцветный газ,
![]() ,
,
![]() .
Ядовит. Аномально высокие температуры
кипения и плавления объясняются усилением
межмолекулярного взаимодействия за
счет образования водородных связей
между молекулами HF.
.
Ядовит. Аномально высокие температуры
кипения и плавления объясняются усилением
межмолекулярного взаимодействия за
счет образования водородных связей
между молекулами HF.
Твердый фтороводород состоит из зигзагообразных полимерных цепей (рис. 2.).
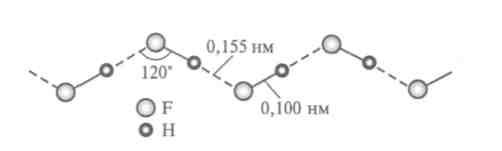 Рис.
2. Зигзагообразные цепи в твердом HF
(пунктир – водородная связь)
Рис.
2. Зигзагообразные цепи в твердом HF
(пунктир – водородная связь)
Фтороводород в жидком и газообразном состоянии значительно ассоциирован вследствие образования водородных связей. В жидком и газообразном HF присутствуют олигомеры (HF)2 до (HF)6. Прим. простые молекулы HF существуют лишь при температуре выше 90 ºС.
С водой HF
смешивается в любых соотношениях. В
разбавленном водном растворе HF
диссоциируют с образованием иона
гидроксония Н3О+
и фторид иона F–.
Фторид иона взаимодействует с молекулой
HF
с образованием гидрофторид аниона (или
фторогидрогенат иона)
![]() :
:
![]()
![]()
![]()
![]()
В водном растворе HF является кислотой средней силы. Сопоставление констант равновесия показывает, что в растворе содержится больше ионов , чем F–. Ион образован за счет водородной связи и имеет линейное строение: [FH–F]–.
При нейтрализации HF гидроксидом калия образуется гидрофторид калия:
![]()
Собственная диссоциация жидкого разбавленного раствора фтороводорода протекает следующим образом:
![]()
Жидкий фтороводород – сильно ионизирующий растворитель. В нем хорошо растворяется вода, фториды, сульфаты, нитраты s-элементов I группы, хуже нитраты s-элементов II группы. Растворенные вещества ведут себя как основания, если при растворении увеличивается концентрация отрицательных ионов . Например:
![]()
Растворенные
вещества ведут себя как кислоты, если
при растворении увеличивается концентрация
положительных ионов
![]() .
.
Например:
![]()
Амфотерными соединениями в жидком HF являются фториды алюминия и хрома.
Характерной особенностью плавиковой кислоты – химическая реакция взаимодействия с оксидом кремния (IV):
![]()
Поэтому плавиковую кислоту хранят не в стеклянной посуде, а в сосудах из свинца, каучука, полиэтилена или парафина. Плавиковая кислота – токсична, при попадании на кожу вызывает болезненные язвы.
В промышленности фтороводород получают действием серной кислоты на флюорит:
CaF2 + H2SO4 (конц.) 2 HF + СaSO4.
Плавиковая кислота применяется для травления стекла (получение матового стела), удаления песка с металлического литья, получения фторидов и т.д.
