
- •Реферат на тему: «Виявлення та визначення генетично модифікованих ознак в харчових продуктах»
- •Розділ 1. Загальні поняття про гмо
- •1.1. Визначення, історія та передумови виникнення
- •Розділ 2. Виявлення та визначення генетично модифікованих матеріалів у харчовій продукції
- •2.1. Загальна характеристика методів аналізу гмо
- •2.2. Методи аналізу фенотипу
- •2.3. Методи визначення специфічних білків, синтезованих трансформованими рослинами (імунодіагностика)
- •2.4. Методи аналізу днк.
- •2.6. Інші методи аналізу рослинного матеріалу на наявність генетичних модифікацій.
- •2.7. Деякі методичні проблеми
- •Висновки
- •Список використаної літератури
2.4. Методи аналізу днк.
Полімеразна ланцюгова реакція (ПЛР) відноситься до найпоширеніших та високотехнічних методів детекції і на сьогодні є основним методом аналізу рослинного матеріалу на наявність генетично модифікованих інгредієнтів. За допомогою ПЛР можна детектувати будь-яку частину впровадженої генетичної конструкції: промотор, структурний ген, термінатор або репортерний ген. ПЛР можна використовувати для рутинного скринінгу ГМО, оскільки відомо, що у більшості конструкцій, які застосовували для генетичної трансформації рослин, присутні або 35S промотор вірусу мозаїки цвітної капусти, або елемент регуляції транскрипції (термінатор) гена нопалінсинтетази з А. tumefaciens (pNOS i tNOS).
Проведення ПЛР аналізу з праймерами до згаданого промотора та термінатора дозволяє детектувати переважну більшість трансгенних рослин. Ідентифікація ГМ рослин потребує повної інформації про структуру впровадженої генетичної конструкції та її аналізу. Аналіз матеріалу на наявність генетичних модифікацій за допомогою цього методу поділяється на кілька етапів:
1. Детекція, загальне визначення присутності ГМО в зразках.
2. При наявності позитивного результату наступний етап включає оцінку типу впровадженої генетичної конструкції та, відповідно, визначення наявності дозволу на реалізацію даного типу генетично модифікованих організмів.
3. Кількісне визначення ГМ організмів.
На першому етапі ПЛР відбувається теплова денатурація ДНК при 93-95°С протягом 1 хв. Крім матриці ДНК суміш містить у надлишку пару праймерів, Таq-полімеразу та чотири дезоксирибонуклеотиди. Температуру суміші повільно знижують, до 55°С, що призводить до зв'язування праймерів з комплементарними послідовностями ДНК. Після цього температуру суміші підвищують до 75°С, величини, оптимальної для Таq-полімерази. Починається синтез комплементарного ланцюга ДНК що ініціюється 3'-гідроксильною групою праймера. Внаслідок багаторазового повторення цих трьох етапів відбувається синтез конкретного сегмента ДНК.
Коли кількість копій ділянки аналізованої ДНК становить мільйон та більше, їх можна аналізувати із застосуванням фізичних методів з УФ або флуоресцентним детектуванням. Інформація про наявність ГМО у зразках отримують визначенням присутності або відсутності конкретного амплікону після проведення гель-електрофорезу продуктів НЛР.

Рис. 3. Схема синтезу конкретного сегмента ДНК методо ПЛР
2.5. Real-time ПЛР
Найпоширенішим методом кількісної оцінки ГМО є метод полімеразної ланцюгової реакції в умовах реального часу (real-time ПЛР) - методика, що базується на постійному моніторингу продуктів ампліфікації. Даний варіант ПЛР дозволяє проводити коректну оцінку нуклеотидного матеріалу (кількість копій геномних еквівалентів вихідної матриці) в будь-який момент часу протягом всього процесу проведення ПЛР аналізу.
Використання методики real-time ПЛР дозволяє:
1. Визначати вихід продукту реакції після кожного циклу ампліфкацїї.
2. Конструювати згідно з отриманими даними кінетичну криву ПЛР.
3. Визначати відносну концентрацію субстрату на основі аналізу цієї кривої.
Для детекції продуктів ампліфікації використовують флуоресцентні барвники, які забезпечують флуоресценцію, прямо пропорційну кількості ПЛР- продукту.
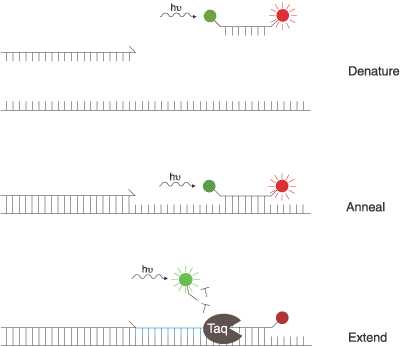
Рис. 4. Принципова схема проведення експерименту з real-time ПЛР
