
- •1.1 Атомно-молекулярное учение химии. Понятия – атом, молекула, относительная молекулярная масса, относительная атомная масса, молярная масса. Моль – мера количества вещества.
- •1.2 Эквивалент. Молярная масса эквивалента. Закон эквивалентных отношений. Закон кратных отношений.
- •1.4 Законы термохимии. Закон Гесса – как частный случай закона сохранения энергии. Следствие из закона Гесса (энтальпия сгорания, образования). Стандартные условия.
- •1.6 Скорость химических реакций. Основной закон химической кинетики – закон действующих масс. Порядок и молекулярность реакции. Правило Ван-Гоффа. Кинетические уравнения.
- •1.7 Зависимость скорости реакции от температуры. Энергия активации. Уравнение Аррениуса.
- •1.8 Катализ. Гомогенный, гетерогенный, ферментативный. Особенности отдельных типов катализа. Примеры.
- •1.9 Химическое равновесие. Константа равновесия. Влияние температуры, концентрации реагентов, давления и катализатора на смещение равновесия.
- •1.10 Химическое равновесие. Принцип Ле-Шателье-Брауна. Характер смещения равновесия в зависимости от типа реакции (экзо- , эндотермические); реакции идущие с изменением объема.
- •1.13 Идеальный раствор. Законы Рауля. Понижение давления насыщенного пара, понижение температуры замерзания, повышение температуры кипения растворов неэлектролитов.
- •1.14 Явление осмоса. Осмотическое давление. Закон Вант-Гоффа применительно к растворам неэлектролитов. Роль осмотического давления в биологических системах.
- •1.17 Слабые электролиты. Степень и константа диссоциации. Взаимосвязь константы и степени диссоциации (закон разбавления Освальда)
- •1.19 Диссоциация воды. Ионное произведение воды. Водородный показатель рН.
- •1.20 Гидролиз солей. Константа и степень гидролиза. Факторы смещения равновесия гидролиза. Необратимый гидродиз.
- •1.32 Комплексные соединения. Особенности структуры комплексных соединений. Номенклатура, координатное число, изомерия. Циклические комплексные соединения.
- •1.25 Строение атома и периодический закон. Периодичность изменения свойств s-, p- и d элементов.
- •1.26 Периодический закон. Свойства атомов: атомный радиус, ионизационный потенциал и сродство к электрону. Относительная электроотрицательность элементов. Металлы и неметаллы, их положение в таблице.
- •1.27 Метод валентных связей. Насыщаемость связи. Направленность связей. Определение валентности по методу валентных связей.
- •1.28 Метод молекулярных орбиталей. Связывающие, разрыхляющие, не связывающие молекулярные орбитали. Порядок связи.
- •1.29 Ковалентная связь. Полярность ковалентной связи. Дипольный момент. Одинарные, двойные и тройные связи.
- •1.30 Межмолекулярное взаимодействие. Ориентационное, индукционное и дисперсное взаимодействие. Водородная связь. Биологическая роль водородной связи и межмолекулярного взаимодействия.
- •1.31 Ионная связь. Степень ионности. Донорно-акцепторный механизм образования ковалентной связи. Металлическая связь.
- •1.3 Основные представления об энергетике химических процессов, функции состояния: внутренняя энергия, энтальпия, энтропия.
- •1.4 Свободная энергия Гиббса. Направление течения процесса. Анализ уравнения энергии Гиббса. Влияние энталальпийного и энтропийного факторов на направление протекания процессов.
- •1.11 Дисперсные системы. Растворы, растворимость. Факторы влияющие на растворимость. Способы выражения концентрации растворов (молярная и мольная концентрации эквивалента, молярная и массовая доли).
- •1.34 Сильные электролиты. Активность. Ионная сила растворов.
- •1.37 Окислительно-восстановительные реакции и окислительно-восстановительные потенциалы. Окислительно-восстановительные реакции, электрохимические явления в биологиических и технологических процессах.
- •2.4 Элементы подгруппы III.А. Электронная конфигурация. Изменение радиуса атома и энергии ионизации. Степени окисления. Аллюминий. Свойства. Характеристика оксидов, гидрооксидов, солей. Амфотерность.
- •2.11 Элементы подгруппы V.А. Электронная конфигурация. Изменение радиуса атома и энергии ионизации. Степени окисления. Фосфор. Свойства. Фосфин. Применение в с/х, биологическая роль.
- •2.19 Элементы подгруппы VI.А. Электронная конфигурация. Изменение радиуса атома и энергии ионизации. Степени окисления. Сера. Свойства. Оксиды серы. Свойства. Применение в с/х.
1.3 Основные представления об энергетике химических процессов, функции состояния: внутренняя энергия, энтальпия, энтропия.
Внутренняя
энергия
(U)
– функция
состояния системы, являющаяся совокупностью
всех видов энергии составляющих ее
частиц. Складывается из кинетической
энергии и потенциальной энергии. Закон
сохранения энергии
– энергия не возникает из ничего и не
исчезает, а только переходит из одного
вида в другой. Изменение энергии
изолированной системы = 0. Теплота
сообщаемая системе, расходуется на
изменение ее внутренней энергии и на
совершение работы против внешних сил.
![]() .
Для реакций протекающих при постоянном
объеме (изохорные), тепло поступающее
в систему идет на увеличение внутренней
энергии
.
Для реакций протекающих при постоянном
объеме (изохорные), тепло поступающее
в систему идет на увеличение внутренней
энергии![]() .
При постоянном давлении (изобарные)
тепло идет на увеличение внутренней
энергии, расширение системы. Энтальпия
–
функция состояния равная внутренней
энергии системы + работа расширения.
.
При постоянном давлении (изобарные)
тепло идет на увеличение внутренней
энергии, расширение системы. Энтальпия
–
функция состояния равная внутренней
энергии системы + работа расширения.
![]() .
При постоянном давлении
.
При постоянном давлении
![]() .2
следствие Гесса.
Изменение
энтальпии хим. реакции = разности между
суммой энтальпий образования продуктов
реакции и суммой энтальпий образования
исходных.веществ.
.2
следствие Гесса.
Изменение
энтальпии хим. реакции = разности между
суммой энтальпий образования продуктов
реакции и суммой энтальпий образования
исходных.веществ.
![]() Энтропия.
(S, дж./моль К) функция состояния системы,
являющаяся термодинамической мерой ее
неупорядоченности.
Энтропия.
(S, дж./моль К) функция состояния системы,
являющаяся термодинамической мерой ее
неупорядоченности.
![]() ,
где
W
– термодинамическая вероятность, К –
постоянная Больцмана (К = 1,38*10-23).
В изолированной системе самопроизвольные
процессы могут протекать только в
направлении увеличения энтропии
,
где
W
– термодинамическая вероятность, К –
постоянная Больцмана (К = 1,38*10-23).
В изолированной системе самопроизвольные
процессы могут протекать только в
направлении увеличения энтропии
![]() .
.
1.4 Свободная энергия Гиббса. Направление течения процесса. Анализ уравнения энергии Гиббса. Влияние энталальпийного и энтропийного факторов на направление протекания процессов.
Энергия
Гиббса
– функция состояния системы, = максимальной
ее работе в изобарном изотермическом
процессе. Связана с энтальпией и энтропией
![]() ,
где Т абсолютная температура,К. Энтальпия
–
функция состояния равная внутренней
энергии системы + работа расширения.
,
где Т абсолютная температура,К. Энтальпия
–
функция состояния равная внутренней
энергии системы + работа расширения.
![]() .
Энтропия
- функция
состояния системы, являющаяся
термодинамической мерой ее неупорядоченности.
В изолированной системе самопроизвольные
процессы могут протекать только в
направлении увеличения энтропии. Для
процессов, протекающих при постоянной
температуре и давлении давлении
энергия Гиббса
.
Энтропия
- функция
состояния системы, являющаяся
термодинамической мерой ее неупорядоченности.
В изолированной системе самопроизвольные
процессы могут протекать только в
направлении увеличения энтропии. Для
процессов, протекающих при постоянной
температуре и давлении давлении
энергия Гиббса
![]() .
Общим критерием самопроизвольного
протекания химического процесса является
уменьшение энергии Гиббса
.
Общим критерием самопроизвольного
протекания химического процесса является
уменьшение энергии Гиббса
![]() анализ
показывает, что для эндотермических
реакций
анализ
показывает, что для эндотермических
реакций![]() сопровождающихся
увеличением беспорядка в системе при
высоких температурах. В случае
экзотермических реакций
сопровождающихся
увеличением беспорядка в системе при
высоких температурах. В случае
экзотермических реакций
![]() сопровождающихся уменьшением беспорядка
при низких температурах. Если
сопровождающихся уменьшением беспорядка
при низких температурах. Если
![]() ,то
процесс в прямом направлении невозможен,
идет обратная реакция.
,то
процесс в прямом направлении невозможен,
идет обратная реакция.
Для![]() ,
как функции состояния
,
как функции состояния
![]() .
.
1.11 Дисперсные системы. Растворы, растворимость. Факторы влияющие на растворимость. Способы выражения концентрации растворов (молярная и мольная концентрации эквивалента, молярная и массовая доли).
Растворы
– однородные системы, состоящие из двух
и более компонентов и продуктов их
взаимодействия. Растворы бывают
Насыщенный
раствор находится в равновесии с твердой
фазой растворенного вещества. Ненасыщенный
– концентрация раствора меньше
концентрации насыщенного раствора.
Перенасыщенный
– содержит вещества больше чем надо
для насыщения раствора (неустойчивая
система). Образование раствора происходит
самопроизвольно. Величина уменьшения
термодинамического потенциала зависит
от состава раствора. Растворение
– химические взаимодействие между
молекулами растворителя и растворяемого
вещества. Концентрация раствора
– количество
растворенного вещества, содержащиеся
в определенном количестве раствора.
Массовая доля –
отношение массы вещества к массе
раствора.
![]() в
долях единицы. Молярная доля
– отношение количества вещества
компонента системы к сумме количеств
веществ компонентов
в
долях единицы. Молярная доля
– отношение количества вещества
компонента системы к сумме количеств
веществ компонентов![]() Моляльная концентрация
– отношение количества вещества
растворенного соединения к массе
растворителя
Моляльная концентрация
– отношение количества вещества
растворенного соединения к массе
растворителя
![]()
Молярная концентрация
– отношение количества вещества
растворенного соединения к объему
раствора.
![]() .
Молярная концентрация эквивалента
– отношение количества вещества
эквивалента растворенного соединения
к объему раствора.
.
Молярная концентрация эквивалента
– отношение количества вещества
эквивалента растворенного соединения
к объему раствора.
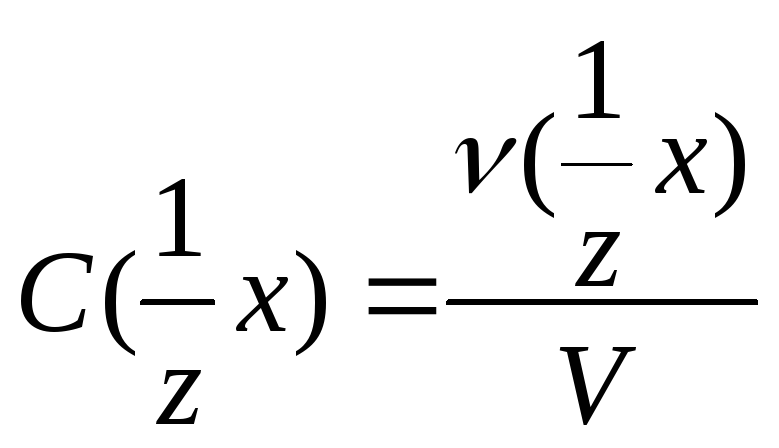 .
В случае когда реагируют в равных объемах
С1/Z*1V1=
С1/Z*2V2
.
В случае когда реагируют в равных объемах
С1/Z*1V1=
С1/Z*2V2
