
- •1. Що вивчає наука колоїдна хімія? Визначте, дві основні ознаки колоїдного стану речовини.
- •Що таке поверхневий натяг і в яких одиницях він вимірюється? Проаналізуйте, як залежить поверхневий натяг від природи речовини, що утворює поверхню міжмолекулярної взаємодії.
- •Проаналізуйте, які поверхневі явища вивчає колоїдна хімія?
- •6.Що називають когезією, адгезією і змочуванням? Які параметри використовують для їх кількісної характеристики?
- •7.Визначте взаємозв'язок між адгезією і здатністю рідини змочувати тверду поверхню. Які Ви знаєте ліофобні і ліофільні поверхні?
- •Що називається адсорбцією і як кількісно її характеризують? Визначте що таке ізотерма, ізостера й ізопікна адсорбції.
- •11.Що таке поверхнева активність? Які речовини називаються поверхнево-активними, поверхнево-інактивними, поверхнево-індиферентними? Наведіть приклади.
- •14.Напишіть рівняння ізотерми адсорбції теорії мономолекулярної адсорбції Ленгмюра. Як визначають константи рівняння Ленгмюра?
- •15.Проаналізуйте рівняння Ленгмюра в залежності від величин с і р.
- •19. Проаналізуйте відмінності між фізичною і хімічною адсорбцією.
- •20.Проаналізуйте, чим відрізняються колоїдні пар від істинно розчинних. Наведіть приклади. Що називають критичною концентрацією міцелоутворення?
- •Проаналізуйте методи визначення ккм. Які фактори впливають на ккм?
- •Дайте оцінку явища солюбілізації. Чим обумовлене це явище? Яке його практичне значення? Які існують способи включення солюбілізата в міцели пар? Що таке пряма і зворотна солюбілізація?
- •23.Проаналізуйте, будову подвійного електричного шару за теоріями Гельмгольца-Перена, Гуї-Чепмена, Штерна. Дайте оцінку можливості практичної реалізації теорії Гельмгольца та назвіть недоліки теорії.
- •23.Проаналізуйте будову міцели ліофобного колоїду. Дайте назву іонам, які входять до складу міцели. З яких частин складається міцела?
- •25.Дайте визначення агрегативної і седиментаційної стійкості ліофобних дисперсних систем.
- •30.Проаналізуйте різницю між ліофільними і ліофобними дисперсними системами. Наведіть приклади.
11.Що таке поверхнева активність? Які речовини називаються поверхнево-активними, поверхнево-інактивними, поверхнево-індиферентними? Наведіть приклади.
Для розведених розчинів для адсорбції розчиненої речовини (неелектроліту) адсорбційне рівняння Гіббса має вигляд:
|
(2.12) |
Для адсорбції газів:
|
(2.13) |
Вплив
природи речовини на адсорбцію та її
знак визначає похідна
![]() .
Її граничне значення за концентрації,
що прямує до 0, П.О. Ребіндер назвав
поверхневою активністю [Дж·м/моль]:
.
Її граничне значення за концентрації,
що прямує до 0, П.О. Ребіндер назвав
поверхневою активністю [Дж·м/моль]:
|
(2.14) |
Поверхнева активність показує, як сильно зменшується поверхневий натяг зі збільшенням концентрації адсорбованої речовини. Фізичний зміст поверхневої активності – сила, яка утримує речовину на поверхні і розрахована на одиницю гіббсівської адсорбції. За впливом на поверхневий натяг води всі речовини розділяють на три групи (рис. 2.1):
1. Поверхнево-активні речовини (ПАР) зменшують σ зі збільшенням концентрації: < 0, Г > 0, g > 0. Концентрація цих речовин на поверхні значно більша, ніж в об'ємі. ПАР мало розчинні в воді, погано взаємодіють з водою. Молекули ПАР мають неполярну (вуглеводневу) частину і полярну функціональну групу. До ПАР належать кислоти (С8 – С18), солі цих кислот, спирти, аміни. Вуглеводневі радикали (С8 – С18) виштовхуються на поверхню, де йде їх орієнтування. У воду занурена полярна група (–СООН, –NH2, –OH, –SO2OH та ін.). Чим довший вуглеводневий радикал, тим більша його гідрофобність, що сприяє виштовхуванню ПАР на поверхню.
2. Поверхнево-інактивні речовини (ПІР). Зі збільшенням концентрації ПІР σ рідини збільшується: > 0, Г < 0, g < 0. Їх адсорбція від'ємна, тобто ПІР концентруються в об'ємі, взаємодіють з водою сильніше, ніж молекули води між собою. До ПІР належать електроліти – кислоти, солі, луги , мурашина кислота, амінооцтова, іони, гідролізовані у воді. Слабке збільшення σ води за присутності ПІР пов'язане з їх малою концентрацією на поверхні.
3. Поверхнево-індиферентні речовини (ПІнР) не впливають на σ води. Вони рівномірно розподілені на поверхні: = 0, Г = 0, g = 0. До цієї групи належать сахари.
|
Рис. 2.1. Залежність поверхневого натягу (а) і гіббсівської адсорбції (б) від концентрації водного розчину ПАР (1), ПІР (2) і ПІнР (3) |
12.Як змінюється поверхнева активність в гомологічних рядах ПАР? Сформулюйте правило Дюкло-Траубе.
Поверхнева активність показує, як сильно зменшується поверхневий натяг зі збільшенням концентрації адсорбованої речовини. Фізичний зміст поверхневої активності – сила, яка утримує речовину на поверхні і розрахована на одиницю гіббсівської адсорбції.
Поверхнева активність ПАР зумовлена дифільною будовою їх молекул. Вуглеводневі радикали (С8 – С18) виштовхуються на поверхню, де йде їх орієнтування. У воду занурена полярна група (–СООН, –NH2, –OH, –SO2OH та ін.). Чим довший вуглеводневий радикал, тим більша його гідрофобність, що сприяє виштовхуванню ПАР на поверхню. Виведенню довголанцюжкових сполук з об'ємної фази протидіє дифузія, яка обумовлена тепловим рухом частинок. При малих значеннях адсорбції ПАР місця на поверхні здебільшого ще вільні. Для цієї області концентрацій ПАР І. Ленгмюр запропонував модель, коли вуглеводневі ланцюги «плавають» на поверхні води (рис.2.2). При цьому гідрофільна частина занурена у воду. Групи CnH2n+1, що знаходяться на поверхні, знижують значення поверхневого натягу. Очевидно, що при цьому кожна метиленова група підвищує значення поверхневої активності. Якісно це описується правилом Дюкло-Траубе: поверхнева активність ПАР із подовженням вуглецевого ланцюгу на одну СН2– групу збільшується приблизно в 3,2 рази. Правило вірне для водних розчинів за кімнатної температури. Причина цієї залежності пов’язана зі зменшенням розчинності внаслідок подовження ланцюгу. При великих концентраціях ПАР повністю заповнює поверхню, значення σ спрямовується до значення, яке притаманне даній ПАР у рідкому стані. Зрештою, вуглеводневим радикалам не вистачає місця на поверхні води, і вони витісняються в газову фазу, утворюючи так званий «частокіл Ленгмюра». Адсорбція досягає гранічного значення Г∞. При досить великих концентраціях для членів гомологічного ряду спостерігається одне і те ж гранічне значення Г∞. Існування однакового Г∞ для членів гомологічного ряду означає, що на одиниці площини одне і те ж число адсорбованих молекул не залежить від їх довжини. Якщо речовина має велику поверхневу активність, то концентрування її на поверхні зумовлює нехтовно малі концентрації речовини в об'ємі порівняно з поверхнею. Це дозволяє знехтувати різницею між А та Г. Для поверхнево-активних речовин .
|
Рис. 2.2. Орієнтація молекул ПАР в адсорбційному шарі при різних значеннях адсорбції |
13.Сформулюйте основні положення теорії Ленгмюра. За яких умов це рівняння застосовне?
Основні припущення теорії Ленгмюра:
Адсорбція викликається валентними силами, або силами залишкової хімічної валентності.
Адсорбція локалізована. На активному центрі адсорбується лише одна молекула адсорбату (тобто утворюється моношар).
Адсорбційні центри енергетично еквівалентні.
Адсорбовані молекули не взаємодіють одна з одною.
Рівняння ізотерми мономолекулярної адсорбції Ленгмюра.
|
(2.28) |
де К і Кр – константа адсорбційної рівноваги; с – концентрація адсорбенту в об'ємній фазі; р – тиск пари адсорбату.
К і Кр характеризують енергію взаємодії адсорбату з адсорбентом. Чим більше К і Кр, тим сильніше взаємодія.
Типова ізотерма адсорбції Ленгмюра наведена на рис. 2.4.
|
|
Рис. 2.4. Ізотерма адсорбції Ленгмюра: а) в координатах А – с; б) лінійна форма в координатах 1/A – 1/c |
|
Для знаходження А∞ і К застосовують лінійну форму ізотерми Ленгмюра:
|
(2.33) |
Теорія Ленгмюра застосовується тільки за відсутності адсорбції над мономолекулярним шаром (хемосорбція, фізична адсорбція за невеликих тисків і температурах вище критичної, а також адсорбція з розчинів).



 a
a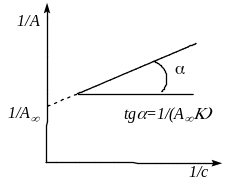 б
б