
- •1. Що вивчає наука колоїдна хімія? Визначте, дві основні ознаки колоїдного стану речовини.
- •Що таке поверхневий натяг і в яких одиницях він вимірюється? Проаналізуйте, як залежить поверхневий натяг від природи речовини, що утворює поверхню міжмолекулярної взаємодії.
- •Проаналізуйте, які поверхневі явища вивчає колоїдна хімія?
- •6.Що називають когезією, адгезією і змочуванням? Які параметри використовують для їх кількісної характеристики?
- •7.Визначте взаємозв'язок між адгезією і здатністю рідини змочувати тверду поверхню. Які Ви знаєте ліофобні і ліофільні поверхні?
- •Що називається адсорбцією і як кількісно її характеризують? Визначте що таке ізотерма, ізостера й ізопікна адсорбції.
- •11.Що таке поверхнева активність? Які речовини називаються поверхнево-активними, поверхнево-інактивними, поверхнево-індиферентними? Наведіть приклади.
- •14.Напишіть рівняння ізотерми адсорбції теорії мономолекулярної адсорбції Ленгмюра. Як визначають константи рівняння Ленгмюра?
- •15.Проаналізуйте рівняння Ленгмюра в залежності від величин с і р.
- •19. Проаналізуйте відмінності між фізичною і хімічною адсорбцією.
- •20.Проаналізуйте, чим відрізняються колоїдні пар від істинно розчинних. Наведіть приклади. Що називають критичною концентрацією міцелоутворення?
- •Проаналізуйте методи визначення ккм. Які фактори впливають на ккм?
- •Дайте оцінку явища солюбілізації. Чим обумовлене це явище? Яке його практичне значення? Які існують способи включення солюбілізата в міцели пар? Що таке пряма і зворотна солюбілізація?
- •23.Проаналізуйте, будову подвійного електричного шару за теоріями Гельмгольца-Перена, Гуї-Чепмена, Штерна. Дайте оцінку можливості практичної реалізації теорії Гельмгольца та назвіть недоліки теорії.
- •23.Проаналізуйте будову міцели ліофобного колоїду. Дайте назву іонам, які входять до складу міцели. З яких частин складається міцела?
- •25.Дайте визначення агрегативної і седиментаційної стійкості ліофобних дисперсних систем.
- •30.Проаналізуйте різницю між ліофільними і ліофобними дисперсними системами. Наведіть приклади.
1. Що вивчає наука колоїдна хімія? Визначте, дві основні ознаки колоїдного стану речовини.
Відповідь. Колоїдна хімія – наука про поверхневі явища і дисперсні системи. До поверхневих явищ належать процеси, що відбуваються на межі поділу фаз, у міжфазному поверхневому шарі, який виникає внаслідок взаємодії супряжених фаз. Особливе значення поверхневі явища мають для дисперсних систем, тобто систем з високорозвиненою поверхнею. Дисперсна система – дво-або багатофазна гетерогенна система, в якій одна з фаз знаходиться у високороздрібленому (високодисперсному) стані. Дисперсна фаза – це роздрібнена фаза. Вона складається з часточок нерозчинного подрібненого тіла, які розподілені по всьому об'єму дисперсійного середовища. Дисперсні системи – це, наприклад, грунти і гірські породи, тканини рослин і тварин, харчові продукти, будівельні матеріали тощо.
Дисперсність і гетерогенність – це дві основні ознаки колоїдного стану речовини. Гетерогенність (багатофазність) вказує на наявність міжфазної поверхні та поверхневого шару. Вона становить собою основну якісну ознаку об'єкта колоїдної хімії. Дисперсність – друга ознака, що визначає розміри тіла в тривимірному просторі. Кількісна міра дисперсності, або просто дисперсність (D), обернено пропорційна лінійному розміру частинок:
D = 1/a. |
(1.1) |
Для сферичних частинок а – це їх діаметр, для кубічних – довжина ребра. Дисперсні системи, які містять однакові за розміром частинки, називаються монодисперсними, а системи з частинками різного розміру – полідисперсними. Інша важлива характеристика дисперсної системи – питома поверхня (sпит). Це поверхня, що припадає на одиницю маси чи об’єму тіла:
sпит= s/V , sпит= s/m, |
(1.2) |
де s та V – сумарні площа і об'єм дисперсної фази. Якщо тіло роздрібнене на n однакових частинок сферичної форми з діаметром d, які утворюють дисперсну фазу, то:
для
кубічних частинок:
Загалом:
|
(1.3) |
де k – коефіцієнт форми.
Для диспергованого тіла з густиною ρ:
|
(1.4) |
Для деяких дисперсних систем sпит може досягати 105 або навіть 106 м2/кг.
Виділення систем з певним розміром часток в особливий клас колоїдних систем не є суто формальним. Висока дисперсність додає речовинам нових якісних ознак: підвищеної реакційної здатності і розчинності, інтенсивності забарвлення, розсіяння світла тощо. Різка зміна властивостей речовини з|із| підвищенням дисперсності пов'язана зі швидким збільшенням сумарної поверхні розділу між частками|частинками| і середовищем|середою|. Велика поверхня розділу характеризується поверхневою енергією, що зумовлена гетерогенністю і дисперсністю. Гетерогенність, яка визначає різкість переходу з одної фази до іншої, ступінь різнорідності фаз, пов’язана з величиною поверхневого натягу σ. Зі зростанням гетерогенності зростає σ, відсутність першої є рівноцінним відсутності другої. Дисперсність визначається площиною міжфазної поверхні s. Тоді поверхнева енергія дорівнює GS= σ·s. σ – то є фактор інтенсивності, а s – фактор ємності. Поверхнева енергія є надлишковою, що викликає прагнення системи до її зменшення або до перетворення на інші види енергії, що супроводжується перебіганням відповідних процесів на поверхні. У цих системах легко протікають самочинні процеси, що приводять до зниження запасу поверхневої|зверхньої| енергії: адсорбція, коагуляція (злипання дисперсних часток|частинок|), утворення макроструктур і тому подібне.|тощо|
Сучасна колоїдна хімія вирішує важливі задачі розкриття природи і механізмів поверхневих явищ із залученням різноманітних фізико-хімічних і специфічних (електрофорез, електроосмос, ультрафільтрація, електродіаліз, нефелометрія тощо) методів експерименту.
Дайте визначення дисперсної системи. Проаналізуйте, за якими ознаками класифікують дисперсні системи. Наведіть приклади дисперсних систем.
Відповідь. Дисперсна система – дво-або багатофазна гетерогенна система, в якій одна з фаз знаходиться у високороздрібленому (високодисперсному) стані. Дисперсна фаза – це роздрібнена фаза. Вона складається з часточок нерозчинного подрібненого тіла, які розподілені по всьому об'єму дисперсійного середовища. Дисперсні системи – це, наприклад, грунти і гірськи породи, тканини рослин і тварин, харчові продукти, будівельні матеріали тощо.
Існують такі основні способи класифікації дисперсних систем за різними ознаками:
за агрегатним станом фаз:
Дисперсна фаза |
Дисперсійне середовище |
Позначення |
Приклад |
Тверда |
Рідина |
т/р |
Золі металів, суспензії |
Рідина |
Рідина |
р/р |
Емульсії: креми, мастила, нафта |
Газ |
Рідина |
г/р |
Мильна піна, протипожежні піни |
Тверда |
Газ |
т/г |
Пил, дими, порошки |
Рідина |
Газ |
р/г |
Тумани, хмари |
Газ |
Газ |
г/г |
Атмосфера Землі |
Тверда |
Тверде |
т/т |
Мінерали, бетон, самоцвіти |
Рідина |
Тверде |
р/т |
Кольорове скло, сплави |
Газ |
Тверде |
г/т |
Пемза, силікагель |
за ступенем дисперсності:
грубодисперсні: частинки розміром 10-2-10-3 см (порошки);
мікрогетерогенні: 10-3-10-5 см (емульсії, суспензії);
ультрамікрогетерогенні: 10-5-10-7 см (золі, дисперсії колоїдних поверхнево-активних речовин). Частки золів невидимі в оптичний мікроскоп, водні системи прозорі, фільтруються крізь звичайні фільтри.
за характером взаємодії частинок дисперсної фази:
вільнодисперсні, у яких частинки дисперсної фази здатні незалежно пересуватися під дією сили тяжіння і теплового руху в дисперсійному середовищі (золі, розбавлені емульсії і суспензії);
зв'язнодисперсні, у яких частинки дисперсної фази пов’язані одна з одною за рахунок міжмолекулярних сил і здійснюють лише коливальні рухи (гелі, драглі).
за характером взаємодії частинок дисперсної фази і дисперсійного середовища:
ліофільні системи, в яких частинки дисперсної фази взаємодіють з розчинником, утворюючи навколо себе сольватні оболонки (міцелярні розчини колоїдних поверхнево-активних речовин, розчини ВМС);
ліофобні системи – частинки дисперсної фази утворені з речовини, яка слабо взаємодіє з рідиною дисперсійного середовища (гідрозолі металів, їх малорозчинних солей).
Окремо, поза класифікацією, є розчини високомолекулярних сполук. Маючи великі розміри молекул, їх розчини є об'єктами вивчення колоїдної хімії. Займаючи положення між дійсними розчинами і колоїдними, вони не є гетерогенними системами. До них відносять розчини білків, полісахаридів, нуклеотидів.




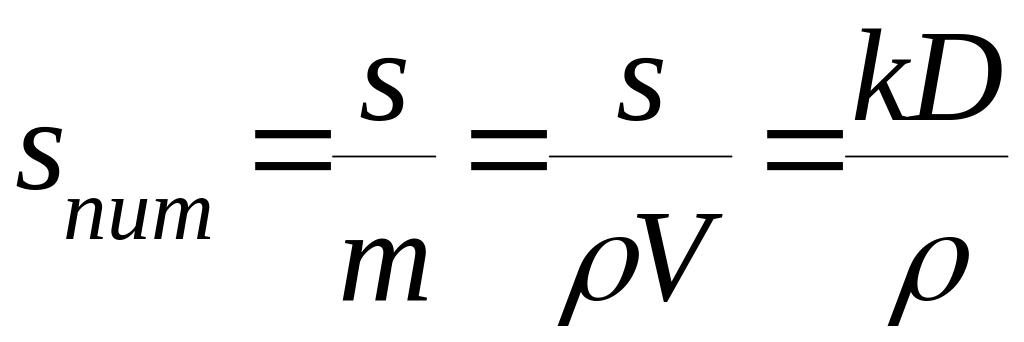 .
.