
- •1. Использование осадочных реакций в клинической лаборатории.
- •7 . Холестерин, содержание в крови, источники, биологическая роль.
- •8. Липопротеины плазмы крови. Состав, строение, биологическая роль. Атерогенные и антиатерогенные липопротеины.
- •9. Липотропные вещества, представители, биологическая роль.
- •10. Формы кислотности желудочного сока. Методы оценки кислотообразующей функции желудка.
- •11. Роль hCl в переваривании белков.
- •14. Характеристика ферментов панкреатического сока.
- •15. Характеристика ферментов кишечного сока
- •16. Индикан, механизм образования, содержание в крови, пути выведения,
- •17. Суточная потребность в белках, жирах, углеводах и воде.
- •19. Содержание креатинина в крови и моче, диагностическое значение.
- •21. Аспартатаминотрансфераза, строение, биологическая роль.
- •22. Аланинаминотрансфераза, строение, биологическая роль. Содержание в крови, диагностическое значение.
- •23. Лактатдегидрогеназа. Строение. Диагностическое значение определения изоферментного спектра.
- •24. Аммиак, источники, содержание в крови и моче. Гипераммониемия, её
- •25. Мочевая кислота. Способы выведения из организма. Нормативные
- •26. Возрастные показатели содержания общего билирубина
- •28. Принцип метода определения билирубина в плазме крови (Метод
- •29. Изменения соотношений форм билирубина и других желчных пигментов
- •30. Уробилин, его происхождение. Диагностическое значение определения в
- •31. Общее содержание белков плазмы крови в различные возрастные
- •32. Белковые фракции плазмы крови. Количественная оценка. Изменения
- •33. Белки острой фазы, диагностическое значение
- •34. Гемоглобин, содержание в крови. Причины изменения
- •35. Фетальный гемоглобин и принцип определения его концентрации в
- •36. Карбоксигемоглобин, содержание в крови. Механизм образования.
- •37. Метгемоглобин, содержание в крови. Механизм образования.
- •38. Гликированный гемоглобин, содержание в крови. Механизм
- •39. Остаточный азот, нормативные показатели. Соотношение
- •40. Формы азотемий и их причины. Возрастные особенности.
- •41. Показатели кислотно-основного состояния, нормативные величины. Методы оценки, диагностическое значение
- •42. Понятие о компонентах, определяющих осмоляльность крови. Нормативные величины, диагностическое значение
- •43. Содержание натрия в плазме и эритроцитах. Биологическая роль.
- •44. Содержанке калия в плазме и эритроцитах. Биологическая роль.
- •45. Содержание кальция в крови. Биологическая роль.
- •46. Содержание фосфатов в крови. Биологическая роль.
- •47. Содержание железа в крови. Источники. Биологическая роль.
- •48.Энзимный профиль тканей и органов.
- •49. Методы определения активности ферментов. Единицы активности.
- •50. Определения активности амилазы в крови. Нормативные величины,
- •51. Диагностическое значение определения креатинфосфокиназы и ее
- •52. Содержания органических веществ в моче и их происхождение
- •53. Глюкозурия, причины и методы открытия глюкозы в моче
- •54. Протеинурия. Причины и методы открытия белка в моче
- •55. Ацетонурия, причины и методы открытия кетоновых тел в моче
- •56. Гематурия, причины и методы открытия крови в моче
- •57. Сравнительный состав коровьего и женского молока по содержанию
- •58.Сравнительный состав коровьего и женского молока по содержанию
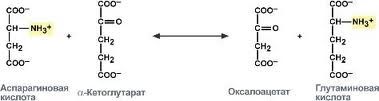
21. Аспартатаминотрансфераза, строение, биологическая роль.
Содержание в крови, диагностическое значение.
АсАТ -
эндогенный фермент из группы трансфераз,
подгруппы аминотрансфераз (трансаминаз),
широко используемый в медицинской
практике для лабораторной диагностики
повреждений миокарда (сердечной мышцы)
и печени.
Аспартатаминотрансфераза синтезируется
внутриклеточно, и в норме лишь небольшая
часть этого фермента попадает в кровь.
При повреждении миокарда (например,
при инфаркте миокарда), печени (при
гепатитах, холангите, первичном или
метастатическом раке печени) в результате
цитолиза (разрушения клеток) этот
фермент попадает в кровь, что выявляется
лабораторными методами. Норма АСТ в
крови: для женщин — до 31 Ед/л, для мужчин
норма АсАТ — до 41 Ед/л. При инфаркте
миокарда ACT повышается в сыворотке
через 6-8 ч, максимальной активности
она достигает при этом заболевании
через 24-36 ч и снижается до нормального
уровня к 5-6-му дню. Расширение зоны
инфаркта приводит к появлению второго
цикла повышения активности, степень
которого является косвенной мерой
обширности зоны поражения. Иногда
активность ACT повышается еще до появления
электрокардиографических признаков
инфаркта миокарда, а отсутствие снижения
ее уровня после 3-4-го дня заболевания
прогностически неблагоприятно. При
инфаркте миокарда активность ACT в крови
может увеличиваться в 2-20 раз.
22. Аланинаминотрансфераза, строение, биологическая роль. Содержание в крови, диагностическое значение.
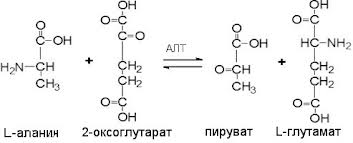
АлАТ - эндогенный фермент из группы трансфераз, подгруппы аминотрансфераз (трансаминаз), широко используемый в медицинской практике для лабораторной диагностики повреждений печени. Аланинаминотрансфераза синтезируется внутриклеточно, и в норме лишь небольшая часть этого фермента попадает в кровь. При повреждении печени (при гепатитах, циррозе печени) в результате цитолиза (разрушения клеток) этот фермент попадает в кровь, что выявляется лабораторными методами. Уровень этой трансаминазы может повышаться также при инфаркте миокарда и других состояниях. Повышение АЛТ, превышающее повышение АСТ, характерно для повреждения печени; если же показатель АСТ повышается больше, чем повышается АЛТ, то это, как правило, свидетельствует о проблемах клеток миокарда (сердечной мышцы). При вирусном гепатите повышение активности фермента происходит в очень ранние сроки - ещё до появления желтухи в продромальный период (отмечается у 50% пациентов - за 5 дней, у 90% - за 2 дня до клинической манифестации заболевания).
Содержание в крови: мужчины: 10-40 Ед/л; женщины: 7-35 Ед/л.
23. Лактатдегидрогеназа. Строение. Диагностическое значение определения изоферментного спектра.
Ф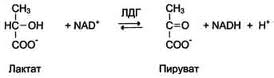 ермент,
принимающий участие в реакциях гликолиза.
Лактатдегидрогеназа катализирует
превращение лактата в пируват, при этом
образуется HADH+. Активной формой
лактатдегидрогеназы является тетрамер
из 4 субъединиц. В организме млекопитающих
имеются два различных типа субъединиц
ЛДГ (H и M), незначительно различающиеся
по аминокислотной последовательности;
они могут ассоциировать в тетрамер
случайным образом. Поэтому известно 5
различных изоферментов ЛДГ.
ермент,
принимающий участие в реакциях гликолиза.
Лактатдегидрогеназа катализирует
превращение лактата в пируват, при этом
образуется HADH+. Активной формой
лактатдегидрогеназы является тетрамер
из 4 субъединиц. В организме млекопитающих
имеются два различных типа субъединиц
ЛДГ (H и M), незначительно различающиеся
по аминокислотной последовательности;
они могут ассоциировать в тетрамер
случайным образом. Поэтому известно 5
различных изоферментов ЛДГ.
Каждая форма имеет характерный полипептидный состав: ЛДГ‑1 состоит из 4 H‑субъединиц, ЛДГ‑2 — из 3 H‑субъединиц и 1 M‑субъединицы, ЛДГ‑3 представляет собой тетрамер из 2 H‑субъединиц и 2 M‑субъединиц, ЛДГ‑4 содержит 1 H‑субъединицу и 3 M‑субъединицы, ЛДГ‑5 состоит только из M‑субъединиц.
Изоферменты, содержащие в основном H‑субъединицы (ЛДГ‑1 и ЛДГ‑2), обладают низким сродством к пирувату и поэтому неспособны эффективно конкурировать за субстрат с пируватдегидрогеназным комплексом. В результате пируват подвергается окислительному декарбоксилированию и в виде ацетил‑КоA вступает в цикл Кребса. Напротив, изоферменты, обладающие главным образом M‑субъединицами (ЛДГ‑4 и ЛДГ‑5), имеют более высокое сродство к пирувату и, как следствие, превращают его в молочную кислоту. Для каждой ткани установлены наиболее типичные изоферменты. Для миокарда и мозговой ткани основным изоэнзимом является ЛДГ‑1, для эритроцитов, тромбоцитов, почечной ткани — ЛДГ‑1 и ЛДГ‑2. В легких, селезенке, щитовидной и поджелудочной железах, надпочечниках, лимфоцитах преобладает ЛДГ‑3. ЛДГ‑4 находится во всех тканях с ЛДГ‑3, а также в гранулоцитах и мужских половых клетках, в последних дополнительно обнаруживается ЛДГ‑5. В скелетных мышцах изоферментная активность располагается в порядке убывания в ряду: ЛДГ‑5, ЛДГ‑4, ЛДГ‑3. Для печени наиболее характерен изофермент ЛДГ‑5, выявляется также ЛДГ‑4.
В норме основным источником активности ЛДГ в плазме крови являются разрушающиеся клетки крови. В сыворотке активность изоферментов распределяется следующим образом: ЛДГ‑2 > ЛДГ‑1 > ЛДГ‑3 > ЛДГ‑4 > ЛДГ‑5. При электрофорезе между фракциями ЛДГ‑3 и ЛДГ‑4 иногда обнаруживается дополнительная полоса изофермента ЛДГ‑X, данный изофермент локализован в тех же органах, что и ЛДГ‑5.
