
- •Методичні рекомендації
- •Оформление результатов работы
- •Оформление результатов работы
- •Лабораторная работа 3 Получение солей действием кислот на минеральное сырье
- •Получение суперфосфата и его анализ
- •Оформление результатов работы
- •Реактивы, используемые при анализе суперфосфата
- •Лабораторная работа 4 Получение хрома и хромовых покрытий электролитическим методом
- •Оформление результатов работы
- •Лабораторная работа 5 Получение уксусной кислоты синтетическим способом
- •Оформление результатов работы
- •Список рекомендуемой литературы
Оформление результатов работы
Описать получение металлического хрома, рассчитать выход по току.
Вопросы и задачи
Почему низок выход хрома по току? На какие процессы расходуется электрический ток при получении электролитического хрома?
Посмотрите положение хрома в электрохимическом ряду напряжений металлов. Почему хром весьма устойчив во влажной, агрессивной атмосфере и в нейтральных растворах электролитов?
Почему соляная кислота активно взаимодействует с хромом, а азотная практически с ним не взаимодействует?
Для определения наличия пор в хромовом покрытии на него накладывают бумагу, смоченную растворами хлорида натрия и гексациано-(ІІІ) феррата калия. На чем основано применение этого раствора?
При электролизе раствора хлорида натрия при напряжении 3,4 В и силе тока 1500А в течение 36 часов было получено 67,94 кг хлора. Определить выход по току и степень использования электрической энергии, если теоретическое напряжение разложения равно 2,19 В.
Лабораторная работа 5 Получение уксусной кислоты синтетическим способом
Синтез уксусной кислоты из ацетилена является типичным примером получения органического вещества из неорганических.
Получение уксусной кислоты включает следующие стадии:
Получение ацетилена.
Гидратация ацетилена по реакции Кучерова.
Окисление уксусного альдегида кислородом воздуха до уксусной кислоты.
Ацетилен получают или из карбида кальция, или термическим разложением метана при 1500—1600°С с последующим быстрым охлаждением полученного пиролизного газа.
Гидратация ацетилена с образованием ацетальдегида протекает хорошо в кислой среде (раствор серной кислоты) в присутствии сульфата ртути (II):
С2Н2 + Н2О = СН3СНО
Нагревание раствора ускоряет процесс гидратации. Поскольку ацетальдегид кипит при 20,8 °С, большая часть его удаляется из реакционного пространства, но некоторая часть ацетальдегида окисляется солями ртути до уксусной кислоты:
CH3CHO + Hg SO4 + Н2О = СН3СООН + H2SO4 + Hg
Поскольку металлическая ртуть не является катализатором, для предотвращения последней реакции в раствор добавляют сульфат железа (III), который окисляет ртуть.
Окисление ацетальдегида до уксусной кислоты протекает в присутствии солей тяжелых металлов, играющих роль переносчиков кислорода. К ним относятся соли марганца, кобальта, ванадия и т. д.
Окисление ацетальдегида проходит довольно медленно, в промышленности не окисленный альдегид направляют на повторное окисление. Осуществить окисление ацетальдегида в лабораторных условиях по циркуляционной схеме довольно трудно.
Окисление быстро идет в присутствии перманганата калия, который в основном действует как окислитель:
2СН3СНО + КМnO4 = СН3СООК + СН3СООН + МnО2
Наряду с уксусной кислотой и оксидом марганца (IV) образуется также и некоторое количество ацетата марганца, который действует как катализатор для реакции окисления альдегида.
Цель работы. Получить раствор уксусной кислоты исходя из карбида кальция. Определить выход уксусной кислоты.
Оборудование и материалы:
1. Колба Вюрца с капельной воронкой.
2. Промывная склянка.
3. Колба с газоотводными трубками и термометром.
4. Пробирка с газоотводной трубкой.
5. Реактивы: хлорид натрия, оксид ртути (II), серная кислота, перманганат калия, карбид кальция, 0,05 н. раствор щелочи.
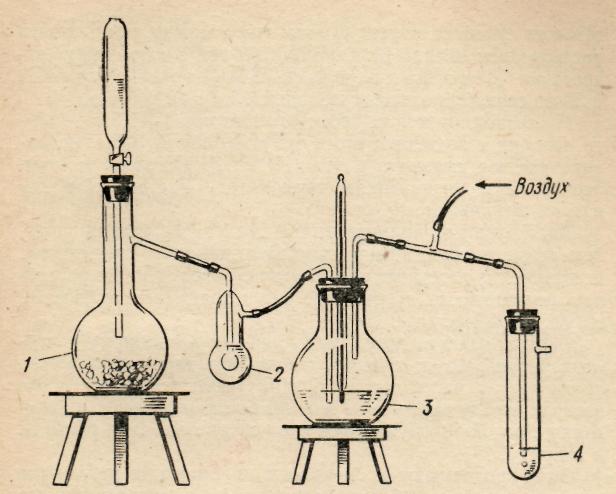
Рис. 3. Получение уксусной кислоты:
1 — колба с карбидом кальция; 2 — промывалка с водой (счетчик пузырьков); 3 — колба с раствором солей ртути; 4 — колба или пробирка с раствором перманганата.
Методика проведения работы.
Работу проводят в приборе (рис. 3). Ацетилен получают, приливая по каплям к карбиду кальция концентрированный раствор хлорида натрия, так как реакция с водой идет слишком бурно. Для снижения скорости реакции в колбу можно предварительно прилить 20 — 30 мл спирта. Взаимодействие карбида кальция с водой должно проходить с такой скоростью, чтобы в промывной склянке в секунду пробулькивал один пузырек. При сильном токе ацетилена выход уксусной кислоты снижается.
Ацетилен поступает в колбу с насыщенным раствором сульфата ртути (II), где и происходит его гидратация и образование уксусного альдегида. Для предупреждения гидролиза сульфата ртути (II) в колбу прибавляют 1 — 2 мл концентрированной серной кислоты. В случае отсутствия готового сульфата ртути (II) его легко можно приготовить растворением оксида ртути (II) в серной кислоте при нагревании. Для этого нужно взять около 1г оксида ртути (II) и 30 мл серной кислоты (разбавленной 1:4).
На технохимических весах отвешивают 1—1,5 г карбида кальция и помещают его в сухую колбу 1. Затем нагревают раствор сульфата ртути (II) до 70 °С, следя за температурой по показаниям термометра. Раствор хлорида натрия приливают по каплям.
Ацетальдегид, получающийся за счет гидратации ацетилена под влиянием катализирующего действия соли ртути, испаряется и поступает в пробирку с разбавленным раствором перманганата калия, где происходит его окисление до уксусной кислоты.
Пары альдегида перед поступлением в пробирку с перманганатом следует смешать с воздухом, который подается из газометра через тройник. Для наблюдения за током воздуха между тройником и газометром включают промывалку с водой. Воздух пускают со скоростью один пузырек в секунду.
Опыт продолжают до прекращения появления пузырьков газа в промывалке 2. После окончания реакции отсоединяют пробирку с раствором уксусной кислоты.
Для отделения раствора уксусной кислоты от оксида марганца (IV) раствор профильтровывают, переливают в мерную колбу на 100 мл, доливают до метки, перемешивают и титруют 0,05 н. раствором щелочи.
Выход уксусной кислоты считают, предполагая, что карбид кальция не имеет примесей. В действительности он всегда имеет загрязнения, и если из чистого карбида должно согласно ГОСТу получиться 370л ацетилена (20 °С, 101,3 Па), то из технического получается 230 — 280 л. Потери продукта происходят также и за счет неполноты гидратации ацетилена и окисления ацетальдегида.
Выход уксусной кислоты рассчитывают как процентное отношение полученного количества уксусной кислоты к тому ее количеству, которое должно получиться теоретически.
