
- •Зондова та скануюча мікроскопія при дослідженні наноматеріалів.
- •3.Рентгенівські методи дослідження наноматеріалів
- •4.Методи мас-спектроскопії при досліджуванні наноматеріалів
- •5. Іч (Саша)
- •Спектроскопія ямр при досліджуванні наноматеріалів
- •Епр(саша)
- •Матеріали, що володіють властивостями молекулярного розпізнавання, їх характеристики, методи одержання та області застосування.
- •9. Плівкові матеріали; їх характеристики; методи одержання та області застосування (плівки, синтезовані методом само зборки, пошарово нарощені плівки та плівки Ленгмюра-Блоджетт).
- •12. Сенсори на основі наноструктурованих систем. Оптичні сенсори на основі оптодів.
- •14. Саша.
- •15. Спектрофотометрія та люмінісценція при дослідженні наноматеріалів.
- •16. Термічні методи аналізу при дослідженні наноматеріалів
- •17. Організовані системи на основі пар у схемах одержання наноматеріалів. Методи одержання, властивості та області застосування
- •18.Методи одержання, властивості та області застосування графену та нанотрубок.
- •19.Методи одержання, властивості та області застосування фулерену та наноалмазів
- •20. Методи одержання, властивості та області застосування наноматеріалів. Наночастинки металів.
- •Методи одержання, властивості та області застосування наноматеріалів. Квантові точки
- •22. Методи одержання, властивості та області застосування наноматеріалів. Матеріали на основі кристалічного силіцію.
- •Методи одержання, властивості та області застосування наноматеріалів. Оксидні матеріали.
- •Перспективи розвитку хім. Сенсорів на основі наноструктурованих систем. Наночіпи, нанофлюїдні системи та інтегровані сенсори.
Методи одержання, властивості та області застосування наноматеріалів. Оксидні матеріали.
Згідно матеріалу лекції (!) оптимальними методами синтезу оксидних наночасточок є:
Електровибух
Плазмохімічний метод
Лазерна абляція
Піроліз
Золь-гель
Сольвотермальний метод
Електровибух
Сучасним методом отримання тонкодисперсних порошків є електровибух провідника при проходженні по ньому потужного імпульсу струму тривалістю 10-5-10-7 с і щільністю 104-106 А/мм2. Для цієї мети використовується дріт діаметром 0,1 -1,0 мм. Електричний вибух провідника являє собою різку зміну фізичного стану металу в результаті інтенсивного виділення енергії в ньому при пропусканні імпульсного струму великої щільності. Електровибух супроводжується генерацією ударних хвиль і створює можливість швидкого нагрівання металів із швидкістю більше 107 К/с до високих температур Т>104 К.
Регулюючи умови вибуху можна отримувати порошки з розміром часточок від 100 мкм до 50 нм. Оксиди металів одержують при проведенні електровибуху на повітрі.
Плазмохімічний метод
Синтез оксидів в плазмі електродугового розряду проводиться шляхом випаровування металу з подальшим окисненням парів або часток металу в кисневмінсеій плазмі. Описаний плазмохімічний синтез наночасток оксиду алюмінію з середнім розміром 10-30 нм. З результатів роботи слідує, що утворення нанопорошків оксиду алюмінію з мінімальним розміром частинок досягається при взаємодії парів металу з киснем повітря в умовах інтенсивного продування повітря, за рахунок чого відбувається швидке зниження температури. Інтенсивне охолодження не тільки гальмує зростання часток, але і збільшує швидкість утворення зародків конденсованої фази. Плазмохімічний синтез з окисненням часток алюмінію в потоці кисневмісної плазми призводить до утворення більш великих часток оксиду в порівнянні з окисненням попередньо отриманого пара металу.
Лазерна абляція
Лазерна
абляція (англ. laser ablation) - метод видалення
речовини з поверхні лазерним імпульсом.
При низькій потужності лазера речовина
випаровується або сублімується у в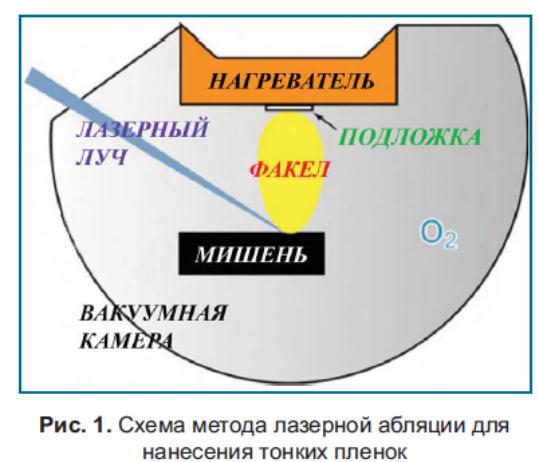 игляді
вільних молекул, атомів і іонів, тобто
над опромінюваною поверхнею утворюється
слабка плазма. При щільності потужності
лазерного імпульсу, що перевищує поріг
режиму абляції, відбувається мікро-вибух
з утворенням кратера на поверхні зразка
і плазми разом з розлітаючими твердими
і рідкими частками.
игляді
вільних молекул, атомів і іонів, тобто
над опромінюваною поверхнею утворюється
слабка плазма. При щільності потужності
лазерного імпульсу, що перевищує поріг
режиму абляції, відбувається мікро-вибух
з утворенням кратера на поверхні зразка
і плазми разом з розлітаючими твердими
і рідкими частками.
П іроліз
іроліз
TiCl4 + 2H2O = TiO2 + 4HCl
Золь-гель синтез
Зазвичай золь-гель метод включає в себе формування металлооксополімерних ланцюгів - золю або гелю з розчинних полігідроксокомплексів, що утворилися в результаті гідролізу металоорганічних комплексних або неорганічних сполук. Утворені гідратовані оксиди надзвичайно хімічно активні. Їх дегідратація відбувається при досить низьких температурах, іноді безпосередньо в процесі гідролізу, і супроводжується утворенням кристалічних оксидів з малим розміром частинок (d≤10 нм) і високо розвиненою поверхнею. При утворенні золів розподілення наночасток за розмірами визначається тривалістю утворення зародків. Як правило, розмір нанокристалів зростає зі збільшенням тривалості реакції (оскільки до поверхні нанокристала надходить більше речовини) і з підвищенням температури (зростає швидкість росту існуючих. Систематичне дослідження реакційних параметрів, таких як тривалість реакції, температура , концентрація і хімічний склад реагентів, дозволяє контролювати розмір, форму і якість нанокристалів.
Сольвотермальний метод
В основі гідротермального методу синтезу лежить висока розчинність великої кількості неорганічних речовин у воді при підвищених температурах і тиску і можливість наступної кристалізації розчиненого матеріалу з рідкої фази. Висока температура води відіграє важливу роль у трансформації матеріалу прекурсору, оскільки при цьому створюється підвищений тиск парів, а сама структура води відрізняється від такої при кімнатній температурі. До того ж при високій температурі змінюються властивості самих реагентів (розчинність, швидкості дифузії, реакційна здатність). Контроль тиску парів, температури і часу реакції надає широкі можливості для синтезу високоякісних наночасток і нанотрубок. У ході процесу ці параметри можуть змінюватись для досягнення максимально високої швидкості спонтанного зародкоутворення і вузького розподілу наночасток за розмірами. Вибір розчинника не обмежується лише водою, а включає й інші полярні і неполярні розчинники, такі, як толуол, бензол, спирт і т.д. Практично метод реалізується нагріванням суміші реагентів у відповідному розчиннику в автоклаві. Гідротермальний синтез проводиться, як правило, при температурах 100-370 ° С (критична точка води: 374,2 °С, 21,4 МПа). У разі використання висококиплячих розчинників температура синтезу може досягати 600 °С. При більш високих температурах реалізують синтез в надкритичних умовах.
Серед інших методів одержання оксидних матеріалів є: механосинтез, співосадження, синтез в обернених міцелах…
Використання: інженерія, електроніка, оптика, в каталізі, трибологія, медицина, молекулярний дизайн, енергетика, як сорбенти, неорганічні пігменти, наповнювачі, магнітні носії інформації, захисні покриття,
Властивості: хімічна стабільність, високий коефіцієнт заломлення, гарні оптичні властивості (TiO2), тугоплавкість, термостабільність, міцність, корозійна стійкість (ZrO2) і т.д.
