
- •Тема 1. Введення в фізико-хімічні методи аналізу.
- •Тема 2. Основи спектроскопії
- •2.1. Характеристика і діапазони електромагнітного випромінювання
- •Тема 3. Рефрактометричний метод аналізу
- •1. Суть рефрактометричних методів аналізу.
- •2. Показник заломлення.
- •3. Вимірювання показника заломлення.
- •3.1. Граничний кут заломлення
- •3.2. Граничний кут повного внутрішнього відбивання.
- •4. Дисперсія речовини і молекулярна рефракція.
- •4. Практичне застосування рефрактометричним вимірів.
- •4.1. Аналіз двокомпонентних систем.
- •4.2. Аналіз трикомпонентних систем.
- •Тема 4. Молекулярно-абсорбційна оптична спектроскопія
- •Загальна характеристика абсорбційних оптичних методів
- •Повна енергiя молекули як сума трьох складових.
- •Особливостi молекулярних спектрiв в уф I видимій областях спектру.
- •Види спектрів
- •Основний закон світлопоглинання (Бугера-Ламберта-Бера)
- •Прилади абсорбційної спектроскопії
- •Кількісний фотоколориметричний аналіз. Фотометричні реакції
- •Вибір оптимальних умов утворення забарвлених сполук
- •Умови фотометрування.
- •13.Переваги та недоліки фотометричних методів
- •Тема 5. Люмінісцетний аналіз
- •5.1. Суть методу.
- •5.2. Механізм люмінесценції
- •5.3. Характеристики люмінесценції
- •5.4. Основні закони люмінесценції
- •Закон Стокса–Ломмеля.
- •Правило дзеркальної симетрії Льовшина.
- •Закон Вавілова с.І.
- •5.5. Гасіння люмінесценції.
- •5.6. Якісний і кількісний люмінесцентний аналіз
- •5.7. Обладнання для проведення люмінесцентного аналізу.
- •Тема 7. Хроматографія
- •7.1. Основні поняття хроматографії
- •1.Суть і особливості хроматографічних методів аналізу
- •2.Основні етапи розвитку хроматографії (на самостійне опрацювання)
- •Класифікація хроматографічних методів аналізу
- •IV. За методикою проведення аналізу:
- •Практичне використання найпоширеніших хроматографічних методів (на самостійне опрацювання).
- •5. Сорбція та розподіл молекул між фазами
- •5.1. Сили міжмолекулярної взаємодії.
- •7.2. Основні положення теорії хроматографічного аналізу
- •Хроматограма та її характеристики
- •Пояснення причин розмивання хроматографічних піків.
- •Селективність колонки
- •Ефективність хроматографічного розділення. Теорія еквівалентних тарілок.
- •Дифузійна (кінетична) теорія
- •Критерій розділення.
- •Вибір температури
- •Газова хроматографія
- •1. 3Агальні положення. Рухома фаза у газовій хроматографії
- •2. Вплив різних факторів на хроматографічне розділення суміші речовин
- •2.1. Вплив швидкості потоку і тиску газу-носія на ефективність розділення.
- •2.3. Хроматографія з програмуванням температури.
- •3. Особливості газоадсорбційної хроматографії. Адсорбенти
- •4. Особливості газорідинної хроматографії
- •Іонообмінна хроматографія
- •1. Загальні відомості. Іонний обмін як принцип розділення.
- •2. Класифікація та властивості іонообмінних сорбентів
- •3. Основні властивості іонітів
- •5.4. Підготовка іонообмінних смол (самостійно з лабораторної роботи)
- •5.5. Застосування іонообмінної хроматографії
4. Практичне застосування рефрактометричним вимірів.
4.1. Аналіз двокомпонентних систем.
Залежність показника заломлення гомогенної двокомпонентної системи від її складу встановлюється експериментально, шляхом визначення показника заломлення для ряду стандартних систем, вміст компонентів у яких відомо.
На підставі отриманих даних викреслюють калібрувальний графік у координатах: показник заломлення – склад. Вимірявши показник заломлення досліджуваної системи, можна за графіком визначити її склад. Для водного розчину цукру (рис. 5), як і для більшості бінарних розчинів, залежність показника заломлення від складу має лінійний характер.

Рис. 5. Залежність показника заломлення водних розчинів деяких речовин від концентрації
Деколи визначення концентрації проводять за таблицями, складеними для сумішей певного складу. Для багатьох водних розчинів кислот, основ, солей, як і для розчинів цукру, різних спиртів, гліцерину та інших речовин, що мають значення в хімічній технології, показники заломлення при різних концентраціях і температурах належно виміряні і в цих випадках можна користуватися таблицею.
Велика різниця в показниках заломлення компонентів системи поряд з підвищеною точністю вимірювання показників заломлення забезпечує і більшу точність аналізу. Якщо різниця в показниках заломлення, що складають систему, дорівнює приблизно 0,1, то точність визначення може скласти соті частки відсотка.
Визначити концентрацію розчинів речовин рефрактометричним методом можна двома способами: розрахунковим та графічним. При використанні графічного способу визначення концентрації розчину речовини будують калібрувальний графік у координатах n-C, вимірюють показник заломлення розчину і за графіком знаходять відповідну концентрацію.
Практика показує, що при вмісті розчиненої речовини, що не перевищує 10-20%, поряд з графічним методом в дуже багатьох випадках можна користуватися лінійним рівнянням, що відображає залежність між концентрацією розчину та його показником заломлення:
n = n0 + F∙C,
в якому n – показник заломлення розчину, n0 – показник заломлення чистого розчинника, C – концентрація розчиненої речовини, F – рефрактометричний фактор, емпіричний коефіцієнт, величина якого може бути знайдена шляхом визначення коефіцієнтів заломлення розчинів відомих концентрацій. Рефрактометричний фактор (F) демонструє зміну показника заломлення при зміні концентрації розчину на 1%. Його встановлюють експериментально або розраховують за таблицями показників заломлення.
Вимірявши коефіцієнт заломлення досліджуваного розчину, можна обчислити його концентрацію:
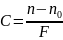
Розчинена речовина завжди може розглядатися як домішка до розчинника і, отже, це ж рівняння може бути застосоване для визначення вмісту домішок в основній речовині.
З попередньої формули ясно, що при рівності величини показника заломлення досліджуваного препарату (n) і показника заломлення цієї ж речовини в чистому вигляді вміст домішок дорівнює нулю. Тому збіг показника заломлення зразка з табличним значенням служить підтвердженням його чистоти. Якщо робота ведеться із сполукою, ще не вивченою, показник заломлення якого ще не визначений, то зміна рефрактометричних характеристик його при рафінуванні вказує на те, що процес очищення відбувається і не може вважатися закінченим доти, поки характеристики ці не стануть постійними.
При ідентифікації речовини також визначають його показник заломлення. Якщо право вважати препарат лише задовільно чистим вимагає збігу показників заломлення з табличними величинами до однієї-двох одиниць в четвертому знаку, то при ідентифікації речовини, при, так би мовити принциповому вирішенні питання про те, з якою речовиною ви маєте справу, необхідна точність на порядок нижче (до 0,001-0,002).
