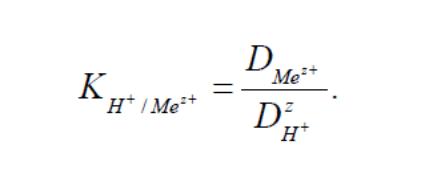- •Тема 1. Введення в фізико-хімічні методи аналізу.
- •Тема 2. Основи спектроскопії
- •2.1. Характеристика і діапазони електромагнітного випромінювання
- •Тема 3. Рефрактометричний метод аналізу
- •1. Суть рефрактометричних методів аналізу.
- •2. Показник заломлення.
- •3. Вимірювання показника заломлення.
- •3.1. Граничний кут заломлення
- •3.2. Граничний кут повного внутрішнього відбивання.
- •4. Дисперсія речовини і молекулярна рефракція.
- •4. Практичне застосування рефрактометричним вимірів.
- •4.1. Аналіз двокомпонентних систем.
- •4.2. Аналіз трикомпонентних систем.
- •Тема 4. Молекулярно-абсорбційна оптична спектроскопія
- •Загальна характеристика абсорбційних оптичних методів
- •Повна енергiя молекули як сума трьох складових.
- •Особливостi молекулярних спектрiв в уф I видимій областях спектру.
- •Види спектрів
- •Основний закон світлопоглинання (Бугера-Ламберта-Бера)
- •Прилади абсорбційної спектроскопії
- •Кількісний фотоколориметричний аналіз. Фотометричні реакції
- •Вибір оптимальних умов утворення забарвлених сполук
- •Умови фотометрування.
- •13.Переваги та недоліки фотометричних методів
- •Тема 5. Люмінісцетний аналіз
- •5.1. Суть методу.
- •5.2. Механізм люмінесценції
- •5.3. Характеристики люмінесценції
- •5.4. Основні закони люмінесценції
- •Закон Стокса–Ломмеля.
- •Правило дзеркальної симетрії Льовшина.
- •Закон Вавілова с.І.
- •5.5. Гасіння люмінесценції.
- •5.6. Якісний і кількісний люмінесцентний аналіз
- •5.7. Обладнання для проведення люмінесцентного аналізу.
- •Тема 7. Хроматографія
- •7.1. Основні поняття хроматографії
- •1.Суть і особливості хроматографічних методів аналізу
- •2.Основні етапи розвитку хроматографії (на самостійне опрацювання)
- •Класифікація хроматографічних методів аналізу
- •IV. За методикою проведення аналізу:
- •Практичне використання найпоширеніших хроматографічних методів (на самостійне опрацювання).
- •5. Сорбція та розподіл молекул між фазами
- •5.1. Сили міжмолекулярної взаємодії.
- •7.2. Основні положення теорії хроматографічного аналізу
- •Хроматограма та її характеристики
- •Пояснення причин розмивання хроматографічних піків.
- •Селективність колонки
- •Ефективність хроматографічного розділення. Теорія еквівалентних тарілок.
- •Дифузійна (кінетична) теорія
- •Критерій розділення.
- •Вибір температури
- •Газова хроматографія
- •1. 3Агальні положення. Рухома фаза у газовій хроматографії
- •2. Вплив різних факторів на хроматографічне розділення суміші речовин
- •2.1. Вплив швидкості потоку і тиску газу-носія на ефективність розділення.
- •2.3. Хроматографія з програмуванням температури.
- •3. Особливості газоадсорбційної хроматографії. Адсорбенти
- •4. Особливості газорідинної хроматографії
- •Іонообмінна хроматографія
- •1. Загальні відомості. Іонний обмін як принцип розділення.
- •2. Класифікація та властивості іонообмінних сорбентів
- •3. Основні властивості іонітів
- •5.4. Підготовка іонообмінних смол (самостійно з лабораторної роботи)
- •5.5. Застосування іонообмінної хроматографії
3. Основні властивості іонітів
До основних властивостей іонітів, що визначають їх якість як сорбентів, належать ємність, кислотно-основні властивості, селективність, набухання, хімічна стійкість, механічна міцність.
Найважливішою характеристикою іоніту є обмінна ємність, яка визначається числом йоногенних груп каркаса і ступенем їх іонізації при даному рН розчину. В аналітичній хімії обмінну ємність відносять до одиниці маси або об'єму іоніту і зазвичай виражають в мілімолях на 1 г сухого або на 1 мл набухлого іонообмінника в Н+ - і Cl- формі або ОН--формі.
Обмінна ємність катіонітів, наприклад за іонами Na+, залежить від рН середовища. Для сильнокислотних катіонітів, до складу яких входять фіксовані аніони сильної сульфатної кислоти, рівноважна обмінна ємність майже не залежить від рН розчину, тоді як для слабокислотних ця залежність є значною і зумовлена силою відповідної кислоти. У сильнокислому середовищі пригнічується дисоціація слабокислотних груп, зменшується кількість протиіонів, які здатні обмінюватись, тобто зменшується обмінна ємність.
Сорбційна ємність іонітів характеризується кількістю розчиненого електроліту, яка була поглинута одиницею маси або об’єму сорбенту.
Кислотно-основні властивості іонітів, як і розчинних електролітів, характеризуються константою кислотно-основної рівноваги (константою дисоціації). Залежно від величини константи дисоціації розрізняють такі групи іонітів:
- сильнокислотні катіоніти КУ-1, КУ-2, СДВ і д р. Ці катіоніти здатні до обміну в кислому, нейтральному і лужному середовищах (R - матриця іоніту);
-слабокислотні катіоніти (КБ-4, КБ-2 і інші), що містять слабодисоціюючі кислотні груп R-COOH, R-SH, R-OH. Здатні до обміну в лужних і слабокислих середовищах;
- високоосновні аніоніти, що містять функціональні четвертинні алкіламонієві групи: R-[N(CH3)3]+OH- чи R-[N(CH3)2C2H4]+OH- і аніоніти з піридинієвими групами R-[C5H4N(CH3)]+OH-. Їх робочий діапазон охоплює всю звичайну кислотну область і майже всю лужну рН від 0 до 12-14). До цієї групи відносяться АВ-17, АВ-18 і ін;
- низькоосновних аніоніти з функціональними аміно- або аміногрупами - NH2 (АН-10, АН -15); -NH (АН-17); -N (АН-18) і звичайним робочим діапазоном (рН <8-9) в кислому і слаболужному середовищі;
- амфотерні іоніти, що містять у своїй структурі одночасно кислотні та основні йоногенні групи. Область катіоонообмінної і аніонообмінної сорбції вужчий, ніж для звичайних, неамфотерних іонітів з такими ж групами. Використовуються АН КБ-1 і АН КБ-2.
Слабокислотні і слабоосновні іоніти при насиченні перші катіонами, а другі – аніонами кислот володіють властивостями, у багатьох відношеннях подібними до властивостей солей слабких кислот або основ: наприклад, вони легко гідролізуються.
Характерна властивість іонітів – набухання при контакті сухого іоніту з розчином. Основна причина набухання іонітів у воді пов'язана з наявністю гідрофільних функціональних груп. Набуханню сприяють також велика обмінна ємність, гідратація протиіонів і розбавлення розчину. Величина набухання має важливе значення для статики і кінетики іонного обміну. Іоніти, які сильно набухають, мають малу ємність на одиницю об'єму, що є непридатним для хімічного аналізу. Від величини набухання залежить швидкість обміну і селективність сорбції.
Іонообмінні матеріали характеризуються різною селективністю по відношенню до протиіонів. Протиіони, які пов'язані кулонівськими силами притягання з функціональними групами, екранують їх заряд. Це притягання залежить від природи протиіона, розмірів, заряду, форми і густини електронних оболонок. Одні іони при рівності концентрацій можуть заміщати в іонообміннику інші.
Для іонообмінників існують ряди селективності, знання яких корисне при виборі систем елюювання. З іонів однакового заряду максимальну іонообмінну здатність проявляють ті іони, радіус яких в сольватованому стані менший, тобто чим менший радіус сольватованого іона, тим більша їх адсорбція:

Адсорбційна здатність іонів залежить також від величини їх заряду. Чим більший заряд іона, тим сильніше він проявляє адсорбційну здатність і за зростаючою здатністю адсорбуватися іони розташовуються в наступний ряд.
![]()
Взаємодія іонообмінної смоли з розчином електроліту включає кілька складних процесів, найбільш важливими з яких є власне іонний обмін, адсорбція іонів і молекул на смолі і набухання смоли за рахунок поглинання розчинника і проникнення електроліту всередину смоли.
Процес власне іонного обміну зворотній і протікає стехіометрично. Якщо, наприклад, катіоніт у водневій формі RH ввести в розчин, що містить іони Са2+, в системі встановиться рівновага:
![]()
тобто в розчині з'являться іони водню, а еквівалентна кількість іонів Са2+ буде поглинена катіонітом.
Рівняння іонного обміну в загальному вигляді нерідко записують як
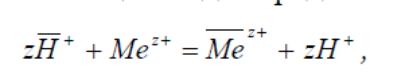
де горизонтальна риска показує приналежність іона до фази іоніту, z -заряд іона.
Аналогічний процес обміну має місце при взаємодії розчину, що містить, наприклад, хлорид, з аніонітом ROH:
![]()
Рівновага в іонообмінній системи характеризується константою іонного обміну:
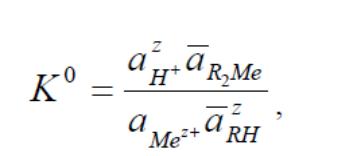
де а – активності іонів в розчині і фазі іонообмінника.
Стан іонообмінної рівноваги залежить від сорбційної здатності іонів Н+ та Меz+ і від їх концентрації в розчині та у фазі іонообмінного сорбенту. Тому рівновага може бути зміщена вправо або вліво зміною активності (концентрації) іонів Н+ та Меz+ у розчині або у фазі сорбенту.
У багатьох випадках при описі іонообмінних рівноваг достатньо використати коефіцієнти рівноваги (або концентраційні константи рівноваги – в термінології, яка використовувалась раніше):
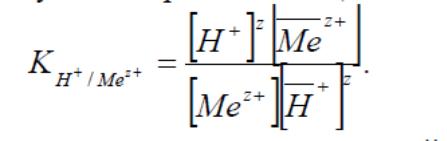
Розподіл кожного йона між смолою і розчином можна охарактеризувати коефіцієнтом розподілу Di:
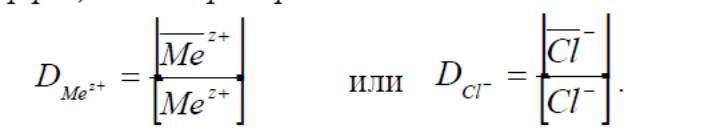
Концентрація іону в розчині зазвичай виражається у моль/л, а у фазі іоніту – молярною частками (ммоль/г або ммоль/мл іоніту). Коефіцієнт рівноваги пов'язаний з коефіцієнтом розподілу співвідношенням: