
- •Тема 1. Введення в фізико-хімічні методи аналізу.
- •Тема 2. Основи спектроскопії
- •2.1. Характеристика і діапазони електромагнітного випромінювання
- •Тема 3. Рефрактометричний метод аналізу
- •1. Суть рефрактометричних методів аналізу.
- •2. Показник заломлення.
- •3. Вимірювання показника заломлення.
- •3.1. Граничний кут заломлення
- •3.2. Граничний кут повного внутрішнього відбивання.
- •4. Дисперсія речовини і молекулярна рефракція.
- •4. Практичне застосування рефрактометричним вимірів.
- •4.1. Аналіз двокомпонентних систем.
- •4.2. Аналіз трикомпонентних систем.
- •Тема 4. Молекулярно-абсорбційна оптична спектроскопія
- •Загальна характеристика абсорбційних оптичних методів
- •Повна енергiя молекули як сума трьох складових.
- •Особливостi молекулярних спектрiв в уф I видимій областях спектру.
- •Види спектрів
- •Основний закон світлопоглинання (Бугера-Ламберта-Бера)
- •Прилади абсорбційної спектроскопії
- •Кількісний фотоколориметричний аналіз. Фотометричні реакції
- •Вибір оптимальних умов утворення забарвлених сполук
- •Умови фотометрування.
- •13.Переваги та недоліки фотометричних методів
- •Тема 5. Люмінісцетний аналіз
- •5.1. Суть методу.
- •5.2. Механізм люмінесценції
- •5.3. Характеристики люмінесценції
- •5.4. Основні закони люмінесценції
- •Закон Стокса–Ломмеля.
- •Правило дзеркальної симетрії Льовшина.
- •Закон Вавілова с.І.
- •5.5. Гасіння люмінесценції.
- •5.6. Якісний і кількісний люмінесцентний аналіз
- •5.7. Обладнання для проведення люмінесцентного аналізу.
- •Тема 7. Хроматографія
- •7.1. Основні поняття хроматографії
- •1.Суть і особливості хроматографічних методів аналізу
- •2.Основні етапи розвитку хроматографії (на самостійне опрацювання)
- •Класифікація хроматографічних методів аналізу
- •IV. За методикою проведення аналізу:
- •Практичне використання найпоширеніших хроматографічних методів (на самостійне опрацювання).
- •5. Сорбція та розподіл молекул між фазами
- •5.1. Сили міжмолекулярної взаємодії.
- •7.2. Основні положення теорії хроматографічного аналізу
- •Хроматограма та її характеристики
- •Пояснення причин розмивання хроматографічних піків.
- •Селективність колонки
- •Ефективність хроматографічного розділення. Теорія еквівалентних тарілок.
- •Дифузійна (кінетична) теорія
- •Критерій розділення.
- •Вибір температури
- •Газова хроматографія
- •1. 3Агальні положення. Рухома фаза у газовій хроматографії
- •2. Вплив різних факторів на хроматографічне розділення суміші речовин
- •2.1. Вплив швидкості потоку і тиску газу-носія на ефективність розділення.
- •2.3. Хроматографія з програмуванням температури.
- •3. Особливості газоадсорбційної хроматографії. Адсорбенти
- •4. Особливості газорідинної хроматографії
- •Іонообмінна хроматографія
- •1. Загальні відомості. Іонний обмін як принцип розділення.
- •2. Класифікація та властивості іонообмінних сорбентів
- •3. Основні властивості іонітів
- •5.4. Підготовка іонообмінних смол (самостійно з лабораторної роботи)
- •5.5. Застосування іонообмінної хроматографії
5.3. Характеристики люмінесценції
Найважливішими характеристиками фотолюмінесценції молекул речовин є їх спектри поглинання, збудження і люмінесценції.
Спектри поглинання молекул зумовлені електронними переходами з основного стану в збуджений, їх представляють у вигляді залежності величини поглинання від частоти (довжини хвилі). Величина поглинання може бути виражена пропусканням (Т,%), оптичною густиною (А) або коефіцієнтом молярного поглинання (ε). При поданні спектра поглинання у вигляді кривих Т,% = f (ν), A = f (ν) або Т,% = f (λ), A = f (λ) вказують товщину поглинаючого шару (l, см) і концентрацію речовини (с, моль / л).
Спектри люмінесценції зумовлені електронними переходами з збудженого стану в основний. Їх представляють у вигляді залежності інтенсивності люмінесценції (I) від частоти (довжини хвилі) випромінювання, що випускається. Він є індивідуальною характеристикою люмінесціюючої речовини і його використовують для ідентифікації. Форма і положення спектру не залежать від довжини хвилі збудження люмінесценції. Це зрозуміло, якщо згадати, що випромінювання завжди відбувається з нижчого коливального рівня першого збудженого стану незалежно від того, який квант поглинається молекулою і на який енергетичний рівень вона при цьому перейде. Форма спектра люмінесценції визначається природою молекули та внутрішніми взаємодіями в ній і практично не залежить від міжмолекулярної взаємодії.
Спектри збудження характеризують активне поглинання, що викликає люмінесценцію молекул речовин. Ці спектри представляють у вигляді залежності інтенсивності люмінесценції від частоти (довжини хвилі) випромінювання, що збуджує люмінесценцію. Спектр збудження за формою дуже схожий на спектр поглинання молекули, може відрізнятися від нього унаслідок інструментальних спотворень.
Розглянемо енергетику люмінесценції. Люмінесценція речовини виникає за рахунок поглинання нею енергії збудження. Однак в енергію люмінесценції перетворюється не вся поглинута енергія збудження – частина поглинутої енергії при фотолюмінесценції витрачається на переходи без випромінювання. Тобто, не всі поглинуті кванти світла hν перетворюються в люмінесценцію. Тому енергія квантів, що випускаються, повинна бути менша за енергію квантів, що поглинаються.
Ефективність перетворення речовиною поглинутої енергії в енергію випромінювання відображають енергетичний (Ве) і квантовий (Вкв) виходи люмінесценції. Енергетичний вихід люмінесценції – це відношення випромінюваної енергії (Елюм) до поглинутої (Епогл):

де Nлюм, νлюм, Nзб, νзб – кількість квантів, частота люмінесценції і кількість поглинутих квантів з відповідною частотою.
Квантовий вихід – відношення кількості квантів випромінювання до кількості поглинутих квантів:
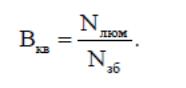
З двох останніх рівнянь одержуємо
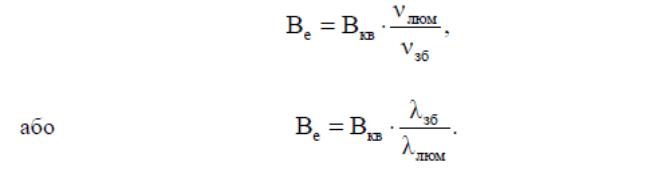
Оскільки λзб < λлюм, то очевидно, що квантовий вихід є частиною енергетичного.
Вихід люмінесценції є характеристичним параметром речовини при фіксованих умовах і значеннях зовнішніх параметрів. Знання величини виходу люмінесценції і впливу різних факторів на цю величину має дуже велике значення для люмінесцентного аналізу. Очевидно, що чим більший вихід люмінесценції для якоїсь певної речовини, тим чутливіша аналітична реакція, яка основана на використанні випромінювання цієї речовини.
Важливою характеристикою люмінесценції є тривалість світіння. Вона являє собою середній проміжок часу, впродовж якого молекули люмінофора залишаються в збудженому стані. Вказану характеристику також називають середнім часом життя збудженого стану. Зазвичай час перебування молекул люмінофора в збудженому стані невелике і становить 10-10 - 10-7 с. Однак іноді вони можуть перебувати у збудженому стані значно більший проміжок часу – від 10-4 до 102 с.
