
- •Тема 1. Введення в фізико-хімічні методи аналізу.
- •Тема 2. Основи спектроскопії
- •2.1. Характеристика і діапазони електромагнітного випромінювання
- •Тема 3. Рефрактометричний метод аналізу
- •1. Суть рефрактометричних методів аналізу.
- •2. Показник заломлення.
- •3. Вимірювання показника заломлення.
- •3.1. Граничний кут заломлення
- •3.2. Граничний кут повного внутрішнього відбивання.
- •4. Дисперсія речовини і молекулярна рефракція.
- •4. Практичне застосування рефрактометричним вимірів.
- •4.1. Аналіз двокомпонентних систем.
- •4.2. Аналіз трикомпонентних систем.
- •Тема 4. Молекулярно-абсорбційна оптична спектроскопія
- •Загальна характеристика абсорбційних оптичних методів
- •Повна енергiя молекули як сума трьох складових.
- •Особливостi молекулярних спектрiв в уф I видимій областях спектру.
- •Види спектрів
- •Основний закон світлопоглинання (Бугера-Ламберта-Бера)
- •Прилади абсорбційної спектроскопії
- •Кількісний фотоколориметричний аналіз. Фотометричні реакції
- •Вибір оптимальних умов утворення забарвлених сполук
- •Умови фотометрування.
- •13.Переваги та недоліки фотометричних методів
- •Тема 5. Люмінісцетний аналіз
- •5.1. Суть методу.
- •5.2. Механізм люмінесценції
- •5.3. Характеристики люмінесценції
- •5.4. Основні закони люмінесценції
- •Закон Стокса–Ломмеля.
- •Правило дзеркальної симетрії Льовшина.
- •Закон Вавілова с.І.
- •5.5. Гасіння люмінесценції.
- •5.6. Якісний і кількісний люмінесцентний аналіз
- •5.7. Обладнання для проведення люмінесцентного аналізу.
- •Тема 7. Хроматографія
- •7.1. Основні поняття хроматографії
- •1.Суть і особливості хроматографічних методів аналізу
- •2.Основні етапи розвитку хроматографії (на самостійне опрацювання)
- •Класифікація хроматографічних методів аналізу
- •IV. За методикою проведення аналізу:
- •Практичне використання найпоширеніших хроматографічних методів (на самостійне опрацювання).
- •5. Сорбція та розподіл молекул між фазами
- •5.1. Сили міжмолекулярної взаємодії.
- •7.2. Основні положення теорії хроматографічного аналізу
- •Хроматограма та її характеристики
- •Пояснення причин розмивання хроматографічних піків.
- •Селективність колонки
- •Ефективність хроматографічного розділення. Теорія еквівалентних тарілок.
- •Дифузійна (кінетична) теорія
- •Критерій розділення.
- •Вибір температури
- •Газова хроматографія
- •1. 3Агальні положення. Рухома фаза у газовій хроматографії
- •2. Вплив різних факторів на хроматографічне розділення суміші речовин
- •2.1. Вплив швидкості потоку і тиску газу-носія на ефективність розділення.
- •2.3. Хроматографія з програмуванням температури.
- •3. Особливості газоадсорбційної хроматографії. Адсорбенти
- •4. Особливості газорідинної хроматографії
- •Іонообмінна хроматографія
- •1. Загальні відомості. Іонний обмін як принцип розділення.
- •2. Класифікація та властивості іонообмінних сорбентів
- •3. Основні властивості іонітів
- •5.4. Підготовка іонообмінних смол (самостійно з лабораторної роботи)
- •5.5. Застосування іонообмінної хроматографії
Види спектрів
В аналітиці використовують спектри випромінювання і поглинання. Спектри бувають суцільні (безперервні), смугасті та лінійчасті. Суцільний спектр випромінювання складається з сукупності електромагнітних хвиль, довжини яких змінюються безперервно. Смугастий спектр складається з декількох смуг, в межах яких довжини хвиль змінюються безперервно, розділених інтервалами відсутності випромінювання. Лінійчасті спектри характеризуються сукупністю випромінювання певних довжин хвиль (рис. 6.).
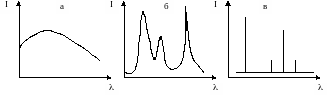
Рис. 6. Види спектрів випромінювання: а - суцільний (безперервний), б - смугастий, в - лінійчастий.
Кожному можливому переходу між рівнями енергії відповідає певна спектральна лінія, яка характеризується в спектрі певною частотою або довжиною хвилі.
Спектр поглинання зображають у вигляді графічної залежності оптичної густини (поглинальної здатності) А або молярного коефіцієнта поглинання (ελ), чи пропускання (Т) від частоти (ν) або довжини хвилі (λ) (рис. 7). Інколи на осі ординат відкладають lg , щоб мати змогу зобразити смуги з малою інтенсивністю поряд з високоінтенсивними. Частота при мінімумі пропускання (ν1, ν2) або довжина хвилі при максимумі поглинання (λ1, λ2) є параметрами для якісного аналізу, а залежність інтенсивності смуг поглинання або оптичної густини від концентрації використовують для кількісного аналізу. Переважно смуги мають правильну дзвоноподібну форму контуру, коли спектр є в координатах “А()”. Якщо в спектрі речовини є декілька смуг, то окремі з них часом можуть перекриватися, і тоді спектр поглинання ускладнюється.
Природа смуг поглинання в ультрафіолетовій (10-400 нм) і видимій (400-760 нм) областях спектра однакова і пов’язана з числом і положенням електронів в молекулах та йонах, а в інфрачервоній області (760-106 нм) – з коливанням атомів в молекулах.
У спектрі поглинання речовини може бути одна і більше смуг. Якщо в спектрі речовини є декілька смуг, то окремі з них часом можуть перекриватися і тоді спектр поглинання ускладнюється.
На відміну від лінійчастих спектрів поглинання атомів, спектр поглинання молекул має смугастий характер, тобто складається з сукупності більш-менш розмитих смуг розділених ділянками практичної відсутності поглинання.
Причиною розмивання спектрів поглинання молекул є те, що електронні і коливальні рівні розщеплюються на коливальні та обертальні підрівні і поглинання супроводжується появою в спектрі великої кількості ліній з близькими довжинами хвиль, які, внаслідок обмеженості розділювальної здатності спектральних приладів, зливаються в смуги поглинання. Внаслідок різного співвідношення енергій електронних, коливальних і обертальних ліній смуги поглинання в УФ діапазоні більш розмиті, а в ІЧ діапазоні складаються з порівняно гострих піків.
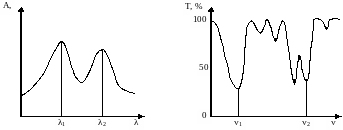
Рис. 7. Залежність А і від λ Рис. 8. Залежність Т від ν
Якісний аналіз за спектрами поглинання грунтується на таких їх властивостях:
1. Немає двох речовин, які б мали абсолютно однаковий спектр поглинання. Тому якісний аналіз (ідентифікацію) речовин проводять шляхом порівняння спектра досліджуваної речовини із спектрами відомих індивідуальних речовин, одержаних в однакових умовах.
2. Число смуг поглинання залежить від числа активних коливань в молекулі. Активними є коливання, які призводять до зміни дипольного момента молекули. Чим більше атомів в молекулі, тим більша кількість активних коливань.
3. Експериментально досліджено, що деякі функціональні групи в складі молекул мають характерні смуги поглинання великої інтенсивності, які мало залежать від загальної будови молекул. Такі смуги поглинання називають характеристичними або груповими.
Наприклад, якщо органічні молекули містять у своєму складі функціональні групи:
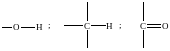
в спектрах поглинання будуть зафіксовані смуги поглинання при таких значеннях хвильових чисел: 3600-3800 ; 3000 та 1720-1780 см-1, відповідно. Аналогічно для неорганічних сполук - наявність груп =Si=O i –O–Si–O–Si–O– призводить до фіксації смуг поглинання з хвильовими числами 785-800 та 480-515 см-1 .
З допомогою характеристичних коливань можна проводити молекулярний, функціональний, а в деяких випадках, і фазовий аналіз.
Зміщення частоти характеристичних коливань дає інформацію про структуру молекули, про внутрішньомолекулярні або міжмолекулярні взаємодії. Таким чином, вивчення спектрів поглинання дає інформацію як про якісний склад, так і про структуру молекул.
Слід відмітити, що через велику кількість органічних і неорганічних речовин і порівняно малий набір функціональних груп, зробити однозначний висновок про якісний склад об'єкту аналізу тільки за даними спектра поглинання важко. Тому молекулярно-абсорбційний метод часто комбінують з іншими фізико-хімічними методами або з попереднім розділенням об'єкта аналізу на чисті компоненти або простіші суміші.
