
- •2.7. Осложнения при эксплуатации систем сбора и транспорта продукции скважин
- •2.7.1. Внутритрубная коррозия трубопроводов и оборудования
- •2.7.2. Образование жидкостных и гидратных пробок
- •2.7.3. Отложение солей
- •2.7.4. Отложения парафина, способы предупреждения, удаление
- •2.7.5. Пульсация давления в промысловых трубопроводах, последствия, методы борьбы
2.7. Осложнения при эксплуатации систем сбора и транспорта продукции скважин
2.7.1. Внутритрубная коррозия трубопроводов и оборудования
Коррозия – химическая реакция материала с окружающей средой, протекающая с изменением состава материала и его свойств.
Возможность протекания процесса коррозии определяется свободной энтальпией реакции, которая для данного процесса отрицательна, а образующиеся вещества термодинамически более устойчивы.
Свободная энтальпия реакции – разность между суммами энтальпий продуктов реакции и вступающих в нее реагентов.

Причём устойчивость металла к коррозии тем выше, чем больше значение окислительно-восстановительного потенциала. По значению этого потенциала все металлы располагаются в ряд активности. Нулевой потенциал – у водорода. Металлы левее водорода (Н) подвержены коррозии: самый нестойкий из применяющихся – Al, затем Zn, Fe, Cr, Ni, Sn, Pb. Металлы правее водорода устойчивы к коррозии – это Cu, Ag, Au, Pt.
Скорость
коррозии
обратно пропорциональна
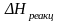 .
Кроме того, на неё оказывают влияние:
.
Кроме того, на неё оказывают влияние:
скорость потока (увеличивает);
концентрация коррозионно-опасных агентов (Н+, HS-, S2-, О2-) и мехпримесей (увеличивает);
температура (увеличивает);
давление (увеличивает) и механические нагрузки;
горизонтальная характеристика газопровода.
Из-за неоднородности металлической поверхности процесс коррозии носит электрохимический характер. При этом на положительно заряженном участке поверхности происходит разрядка водорода и образование ОН—групп:

На аноде – окисление железа:
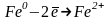
Процесс коррозии может протекать только во влажной среде при наличии на поверхности металла плёнки электролита. В системе нефтегазосбора определяющим в коррозионном отношении будет фактор обводнённости продукции и влажности газа. При достижении значений обводнённости, характерных для точки инверсии смачивания (50%), коррозионные процессы становятся возможными. При транспортировании безводной нефти или сухого газа коррозия маловероятна.
Виды коррозии по виду и месту локализации:
Поверхностная (сплошная) – равномерный съём металла по всей поверхности.
Язвенная – различный по величине съём металла на разных участках поверхности.
Щелевая – возникает в обусловленных конструкцией щелях или под отложениями и приводит к локально высоким скоростям коррозии.
Гальваническая – в случае, когда металлы разной активности электропроводно связаны между собой. В этом случае более инертный металл становится катодом и не разрушается. Этот принцип используется при катодной защите.
Точечная (питтинговая) коррозия наблюдается на аустенитной стали. В отличие от язвенной, остальная поверхность остаётся без изменений, не считая питтингов.
Водородная (инициируемая водородом, охрупчивание) возникает в сероводородной и кислой среде. Атомарный водород диффундирует в структуру стали, которая становится хрупкой и теряет механическую прочность.
Коррозионное растрескивание – одновременное влияние нагрузки, в том числе знакопеременной, на растяжение и коррозионной среды (при пульсациях.
Виды коррозии по химической природе:
Углекислотная:
3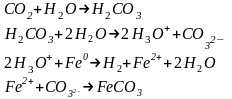
Сероводородная:

Микробиологическая – возникает в присутствии биоценозов бактерий, в результате жизнедеятельности которых выделяются СО2 и Н2S.

Кислородная:

Контроль коррозии осуществляется двумя методами:
электрохимическим – путём замера поляризационного тока или сопротивления;
гравиметрическим – путём замера потери массы образца-свидетеля после экспозиции его в коррозионной среде.
Защита от коррозии:
Использование ингибиторов коррозии. Ингибиторы могут различным образом воздействовать на отдельные ступени процесса коррозии. Общим признаком является то, что уже в малых количествах (г/т) замедляют процесс коррозии без значительного изменения концентрации коррозирующих агентов.
Механизм действия ингибиторов коррозии :
воздействие на анодный или катодный процесс: кинетическое торможение отложения продуктов коррозии металла на катоде;
пассиваторы (дихроматы, ванадаты) относятся к анодным ингибиторам за счёт образования защитного слоя оксидов на металле;
физически действующие ингибиторы адсорбируются на поверхности металла и создают защитную плёнку, действующую как диффузный барьер и замедляющую массообмен в коррозионном процессе;
органические плёнкообразователи;
вещества, вступающие в химическую реакцию с продуктами коррозии, со средой или металлом с образованием защитных слоёв;
вещества, связывающие коррозирующий агент.
Требования к ингибиторам коррозии:
обеспечивать защитный эффект не ниже 85-90% при малых концентрациях (100 г/м3);
иметь высокую адгезию к поверхности металла;
быстро образовывать плёнку;
иметь избирательную растворимость.
Защитные покрытия: лаки, эпоксидные смолы, полимерные покрытия, металлические покрытия.
Механизм защитного действия металлических покрытий связан как с его экранирующим действием к потоку водорода, так и с электрохимическим поведением стали с покрытием.
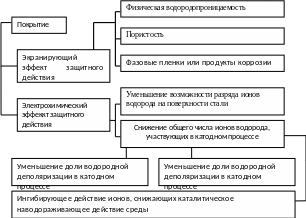
Экранирующий эффект покрытий связан в основном с их водородопроницаемостью, зависящей от природы металла, его пористости и особенностей технологии нанесения. Наиболее эффективны здесь цинк, алюминий, медь, кадмий, растворимость водорода в которых на два порядка ниже, чем у стали.
Механизм действия неметаллических покрытий связан с экранирующим действием и электрохимическими процессами на границе покрытия и металла.
