
- •Н.Д. Наракидзе, д.В. Шайхутдинов
- •Электрические измерения неэлектрических величин
- •Учебное пособие
- •Г. Новочеркасск
- •1.Физико-технические основы измерительног преобразования. Классификация преобразователей. Основные статические и динамические характеристики
- •1.1. Физико-технические основы построения измерительных преобразователей
- •1.2 Метод электромеханических аналогий
- •1.3 Теория измерительных преобразователей
- •1.4. Основные понятия и определения. Классификация измерительных преобразователей. Основные характеристики и параметры измерительных преобразователей
- •1.4.1. Основные понятия и определения
- •1.4.2. Классификация измерительных преобразователей
- •1.4.3. Основные характеристики и параметры ип
- •2 Резистивные измерительные преобразователи
- •2.1 Физические основы проводимости
- •2.2 Электроконтактные преобразователи и преобразователи контактного сопротивления
- •2.3 Реостатные измерительные преобразователи
- •2.4 Тензорезистивные преобразователи
- •2.5 Терморезистивные измерительные преобразователи
- •2.6. Фотоэлектрические измерительные преобразователи
- •2.7. Магнитоуправляемые преобразователи
- •3. Емкостные преобразователи
- •4. Индуктивные преобразователи
- •6. Индукционные преобразователи
- •7. Пьезоэлектрические преобразователи
- •Свойства пьезоэлектрических преобразователей.
- •8. Термоэлектрические преобразователи (термопары)
- •9. Электрохимические измерительные преобразователи
- •9.1. Основные законы электрохимии
- •9.1.1. Диссоциация
- •9.1.2. Электропроводность
- •9.1.3. Электролизом
- •9.1.4 Электродный потенциал
- •9.1.5 Граничный потенциал
- •9.1.6 Явление поляризации
- •9.1.7 Электрокинетическое явление
- •9.2 Электролитические преобразователи сопротивления
- •9.3 Гальванические преобразователи
- •9.4 Кулонометрические преобразователи
- •9.5 Полярографические преобразователи
- •9.6 Химотронные преобразователи (ионисторы)
- •9.7 Электрокинетические преобразователи
- •10. Электронные и ионные измерительные преобразователи
- •10.1. Ионные преобразователи малых концентраций газа (вакуумметры)
- •10.2. Электронные преобразователи перемещения
- •10.3. Масс-спектрометры
- •10.4. Ионизационные преобразователи
- •Список литературы
9.3 Гальванические преобразователи
Принцип действия гальванических преобразователей (ГП) основан на зависимости ЭДС гальванической цепи от концентрации ионов в электролите и окислительно-восстановительных процессов, происходящих на электродах. ГП используют в основном как преобразователи концентрации водных растворов солей, кислот, щелочей и, в частном, как преобразователи pH – метров для измерения активности водородных ионов. ГП используют также в качестве образцовых мер ЭДС – нормальных элементов.
С ущность преобразователя концентрации водородных ионов заключается в следующем. Молекулы воды диссоциируют на ионы водорода Н+ и гидроксила ОН-, т.е. Н2О= Н++ОН-. При этом остается постоянной константа диссоциации:
где
![]() ,
,
![]() ,
,
![]() – активности соответствующих ионов.
Установлено, что при температуре 22 оС
ионное произведение воды:
– активности соответствующих ионов.
Установлено, что при температуре 22 оС
ионное произведение воды:![]() – постоянно и равно
– постоянно и равно
![]() (г-ион/л)2.
В чистой воде или в нейтральном растворе
активности Н+
и ОН-
равны:
(г-ион/л)2.
В чистой воде или в нейтральном растворе
активности Н+
и ОН-
равны:
Ионное произведение
воды остается постоянной не только для
воды, но и для любого водного раствора,
включая растворы кислот с избытком
ионов Н+
или оснований с избытком ОН-.
У кислотных растворов
>
![]() ,
а у щелочных растворов
<
.
Таким образом, для характеристики
растворов достаточно знать активность
водородных ионов, которые для удобства
записи и вычислений численно характеризуют
отрицательным логарифмом активности
ионов водорода – водородным показателем
pH:
,
а у щелочных растворов
<
.
Таким образом, для характеристики
растворов достаточно знать активность
водородных ионов, которые для удобства
записи и вычислений численно характеризуют
отрицательным логарифмом активности
ионов водорода – водородным показателем
pH:
Д![]() иапазон
измерения рН
водных растворов
обычно составляет 014
ед. В
неводных растворах, например в аммиаке
032,7
ед., в муравьиной кислоте 06,1
ед. и т.д. Большие водные концентрации
кислот характеризуются рН=02,
малые концентрации рН=36;
малые концентрации оснований имеют
рН=811,
большие имеют рН=1214.
Изменение соотношения между ионами
происходит за счет воссоединения части
образовавшихся ионов Н+
с ионами ОН-.
иапазон
измерения рН
водных растворов
обычно составляет 014
ед. В
неводных растворах, например в аммиаке
032,7
ед., в муравьиной кислоте 06,1
ед. и т.д. Большие водные концентрации
кислот характеризуются рН=02,
малые концентрации рН=36;
малые концентрации оснований имеют
рН=811,
большие имеют рН=1214.
Изменение соотношения между ионами
происходит за счет воссоединения части
образовавшихся ионов Н+
с ионами ОН-.
В качестве естественной величины в рН-метрах является концентрация водородных ионов, а выходной – гальваническое напряжение, равное разности электродных потенциалов. рН-метры состоят из измерительного и вспомогательного электродов, помещенных, соответственно, в исследуемый раствор и образцовый. Образованные таким образом гальванические элементы называются измерительными и вспомогательными элементами. Вспомогательный полуэлемент предназначен для съема разности электродных потенциалов и характеризуется постоянством и стабильностью своего электродного потенциала.
В лабораторных рН-метрах вспомогательный полуэлемент выполнен в виде водородного элемента с электролитом, активность водородных ионов которого =1 г-экв/л. Для пары водородных полуэлементов связь между ЭДС и показателем рН при температуре 18оС равна:
Ев= - 0,058 рН.
В производственных условиях в качестве вспомогательного главным образом используются каломельный (Hg2Cl2) или хлорсеребряный полуэлемент. При использовании каломельного полуэлемента разность потенциалов определяется с поправкой на граничный потенциал каломельного элемента:
Ев= 0,284+0,058 рН.
В качестве измерительных электродов применяются водородный, хингидронный, сурьмяный и стеклянные электроды. В качестве водородного электрода используются пластина из черненой платины (для лучшей адсорбции) с выводом в помещенной в исследуемый раствор, содержащий ионы Н+. Пластины платины непрерывно омываются чистым водородом. При этом на электроде происходит реакция Н2=2Н++2е. Платина не участвует в реакции с электролитом и является лишь проводником электронов и носителем водорода (рисунок 9.7).
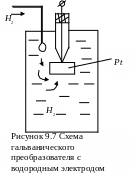
Хингидронный электрод образуется на базе пластинки платины после добавления в исследуемый раствор хингидрона C6H4O2· C6H4(OH)2. С каломельным полуэлементом при температуре 18оС ЭДС такой цепи определяется формулой Ех=0,457-0,058 рН. Такой электрод ускоряет установление потенциала рН-метра.
Сурьмяный электрод представляет собой литой стержень из сурьмы, опускаемый непосредственно в используемый раствор. Такой электрод используют при невысокой точности для растворов с рН=2÷12.
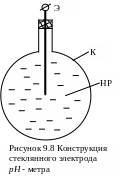
Стеклянный электрод получил наибольшее распространение в рН-метрах (рисунок 9.8). он представляет собой шаровую тонкостенную колбочку, выдуваемую на конце трубки из специальных сортов стекла (63% SiO2, 22% PbO, 7,5% K2O, 7,5% Na2O или электроды Бекмана 67% SiO2, 8% BaO, 25% LiO2). Толщина стенок колбочки 0,05÷0,1 мм. Колбочка заполняется контрольным раствором (нормальным или децинормальным) какой-либо соли или кислоты и погружается в исследуемый раствор, концентрацию которого надо измерить. На границе стекло-раствор появляется определенный потенциал, зависящий от активности водородных ионов исследуемого раствора. Обе поверхности нужно рассматривать как водородные электроды, один из которых должен иметь постоянный потенциал. Промежуточный слой стекла является по существу проводником, соединяющим оба электрода.
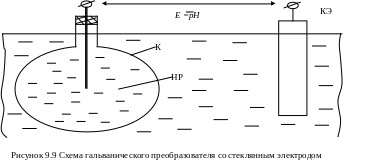
Гальванический преобразователь с стеклянным электродом обычно состоит из стеклянного электрода и двух вспомогательных полуэлементов, которые используются для снятия потенциала с внутренней и внешней поверхностей стеклянного электрода (рисунок 9.9). Конструкции стеклянных электродов весьма разнообразны и они определяются назначением рН-метров (химия, вязкие среды, медицинские приборы, проточные анализаторы рН и многие др.).
В качестве измерительных цепей используются усилители с большим входным сопротивлением (108÷1010 Ом), наиболее часто используется компенсационный метод измерения, обеспечивающий измерение ЭДС (но не падение напряжения в цепи). Использование высокоомных измерительных цепей также снижает явление поляризации электродов.
Градуировка рН-метров производится с помощью буферных растворов ГОСТ 10170-62, ГОСТ 10171-62, обладающих высокой стабильностью значений рН. Значение рН буферных растворов установлены в диапазоне температур 0÷90оС с погрешностью 0,01рН. Примеры названий буферных растворов: 0,05m раствор тетраксилата калия, 0,05m раствор кислого фталиевого калия и др.
Основное влияние на точность изменения рН оказывают температурные погрешности за счет изменения ЭДС измерительных и вспомогательных полуэлементов, изменение внутреннего сопротивления особенно стеклянного электрода. Так, например, у преобразователя со стеклянным электродом абсолютная погрешность в диапазоне температур 15÷55оС составляет рН=0,013рН/град. Для уменьшения погрешностей используют электрические цепи температурной коррекции.
Гальванические преобразователи используются также для измерения активности не только водородных ионов, но и ионов других элементов: K, Na, Cl, Cu, S. Применяются различные ионоселективные электроды из стекла, смол, Cu, Au, Ag, Sn и др.
Отметим еще важное свойство гальванических преобразователей. При неизменной концентрации электролита и постоянной температуре ЭДС гальванической цепи может быть весьма стабильной, что используется для создания нормальных элементов (Н.Э.), применяемых в качестве мер ЭДС, эталона вольта. Например, насыщенные Н.Э. характеризуются высокой воспроизводительностью и стабильностью ЭДС во времени, но относительно высоким ТКС (около 50 мкВ/К). Действительное значение ЭДС (в вольтах) при температуре определяется по формуле:
Е= Е20-0.0000406 (-20)-0.00000095(-20)2+0.00000001(-20)3
где Е20 – действительное значение ЭДС при =20оС, указанное в аттестате нормального элемента.
Для сохранения метрологических характеристик Н.Э. насыщенные Н.Э. нельзя даже кратковременно нагружать током более 1 мкА, а ненасыщенные – более 10 мкА.
