
- •Основные механизмы окисления веществ в тканях (оксидазный, оксигеназный, пероксидазный и перекисное окисление липидов).
- •2. Современные представления о биологическом окислении, особенности аэробного метаболизма. Роль кислорода.
- •6. Опишите механизм действия пиридинзависимых дегидрогеназ (механизм действия над в окислительно-восстановительных реакциях).
- •8. Опишите механизм действия флавинзависимых дегидрогеназ (механизм действия фад и фмн в окислительно-восстановительных реакциях).
- •9. Опишите формулу коэнзима q (убихинон) и механизм его действия в окислительно-восстановительных реакциях. Какова его роль в дыхательной цепи?
- •11. Как происходит синтез эндогенной воды? Сколько ее образуется в сутки?
- •12. Сопряжение окисления и фосфорилирования. Точки сопряжения. Укороченный вариант цепи биологического окисления
- •1 3. Объясните механизм окислительного фосфорилирования (хемиосмотическая гипотеза) и формирование электрохимического потенциала при переносе электронов по дыхательной цепи.
- •14. Разобщение окисления и фосфорилирования. Физиологическое и патологическое значение.
- •15. Коэффициент р/о как показатель эффективности окислительного фосфорилирования.
- •16. Отношение атф/адф как регулятор окислительного фосфорилирования. Дыхательный контроль.
6. Опишите механизм действия пиридинзависимых дегидрогеназ (механизм действия над в окислительно-восстановительных реакциях).
Механизм действия НАД и НАДФ. Коферменты НАД и НАДФ работают в клетке только вместе с белковой частью, образуя сложные ферменты дегидрогеназы. Специфичность связывания коферментов НАД и НАДФ с ферментами-белками зависит от адениннуклеотидной части их молекул, в то время как никотинамидная часть этих молекул осуществляет перенос электронов и протонов от окисляемого субстрата. Пиридиновое кольцо никотинамида имеет положительный заряд у четвертичного атома азота (поэтому окисленную форму НАД записывают в виде НАД+). Это вызывает смещение электронной плотности в пиридиновом кольце и появление положительного заряда у атома углерода в параположении. К нему присоединяется гидрид-ион (Н-), образующийся при неравномерном распределении электронов между атомами водорода: 2Н = Н- + Н+. Другой атом водорода, потерявший электрон (Н+), освобождается в окружающую среду, подкисляя ее. В результате образуется восстановленная форма НАД, записываемая в виде НАД.2Н или НАД.Н+Н+. Дегидрогеназные реакции с участием в качестве коферментов НАД и НАДФ имеют ряд характерных особенностей, которые обусловливают их ключевую роль в процессах биологического окисления. Первая особенность дегидрогеназных реакций - их легкая обратимость при небольших изменениях свободной энергии, что позволяет коферментам участвовать как в окислении субстрата, так и в восстановлении продуктов реакции (в зависимости от потребностей клетки). Вторая особенность заключается в способности этих коферментов (как в окисленной, так и в восстановленной форме) легко отделяться от белка-носителя, их высокой подвижности, что облегчает обмен атомами водорода и электронами между различными дегидрогеназными системами, расположенными в разных частях клетки. Коферменты НАД и НАДФ способны акцептировать водород от большого числа субстратов, окислительно-восстановительный потенциал которых ниже -0,3 В. К числу таких субстратов относятся продукты расщепления углеводов, жиров и различных аминокислот.
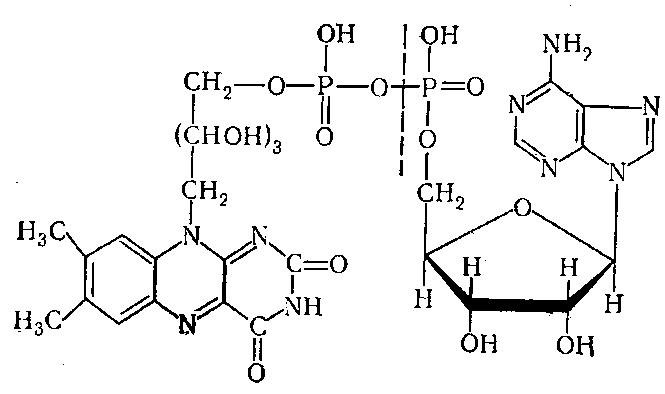
7. Опишите формулы окисленных и восстановленных форм флавиновых коферментов (ФМН, ФАД). Какая часть структуры ФМН и ФАД является акцептором (донором) в переносе электронов и протонов (формулы)? Частью каких комплексов они являются?
Флавиновые
ферменты –
это сложные ферменты, небелковая часть
которых представлена простетическими
группами ФМН (флавинаденинмононуклеотид)
или ФАД (флавинадениндинуклеотид).
ФМН
состоит из изоаллоксазинового кольца,
спирта рибитола (вместе они образуют
витамин В2 –
рибофлавин) и фосфорной кислоты, ФАД
содержит дополнительно адениловый
нуклеотид. Молекулярная структура ФАД
имеет вид:
 В
отличие от никотинамидных коферментов
ФМН и ФАД прочно (ковалентно) связываются
с соответствующими дегидрогеназными
белками и не отщепляются ни на одной из
стадий каталитического процесса.
Реакции, катализируемые флавинзависимыми
дегидрогеназами, трудно обратимы, и,
следовательно, флавиновые коферменты
не могут служить источником водородных
атомов в процессах
восстановительного биосинтеза, подобно
никотинамидным коферментам.
В
отличие от никотинамидных коферментов
ФМН и ФАД прочно (ковалентно) связываются
с соответствующими дегидрогеназными
белками и не отщепляются ни на одной из
стадий каталитического процесса.
Реакции, катализируемые флавинзависимыми
дегидрогеназами, трудно обратимы, и,
следовательно, флавиновые коферменты
не могут служить источником водородных
атомов в процессах
восстановительного биосинтеза, подобно
никотинамидным коферментам.
