
- •Тема 5 Кислотно-основное титрование
- •Изменение значений pH в процессе титрования сильных и слабых кислот и оснований.
- •Кривые титрования кислот основаниям и оснований кислотами.
- •Факторы, влияющие на величину и положение скачка титрования.
- •Индикаторы кислотно-основного метода.
- •Тема 7 Комплексонометрическое титрование
- •Понятия «внутренняя и внешняя координационная сфера», «дентатность лиганда», «координационное число».
- •Комплексонаты металлов: состав, образование, устойчивость, показатель концентрации иона металла, общие и условные константы устойчивости.
- •Кривые комплексонометрического титрования.
- •Использование комплексонометрии для решения различных задач химического анализа.
Тема 5 Кислотно-основное титрование
Изменение значений pH в процессе титрования сильных и слабых кислот и оснований.
Титрование сильной кислоты сильным основанием. До ТЭ значение рН определяется только ионами водорода за счет неоттитрованной сильной кислоты, поскольку другими источниками можно пренебречь. Для расчета рН можно пользоваться формулой:
Lg[A]=lgc0+lg(1-f), рН=-lgc0-lg(1-f).
За ТЭ значение рН определяется избытком добавленного титранта – сильного основания по формуле:
рН=рКw+lgcT+lg(f-1).
В ТЭ значение рН определяется ионами водорода, поступающими за счет автопротолиза воды, по формуле:
рН= рKw
рKw
Титрование слабой кислоты сильным основанием. В начале титрования в растворе находится только слабая кислота. В растворе кислоты при степени ее диссоциации менее 5%
[H+]= ac0
и рН=1/2(рКа+рс0).
ac0
и рН=1/2(рКа+рс0).
До ТЭ при титровании получается сопряженное основание, и раствор представляет собой буферную смесь, поэтому рН вычисляют по формуле
[H+]=K0 =Ka
=Ka
В ТЭ вся кислота оттитрована, и рН раствора определяется наличием сопряженного основания. В растворе слабого основания
[OH-]= bcB; [H+]= Kw/ bcB и рН=14-1\2рКb-1/2рс0.
Поскольку при титровании количество получившегося основания равно исходному количеству кислоты, пренебрегая изменением объема, можно считать что сВ=с0.
После ТЭ основным источником ОН- - ионов будет добавленное сильное основание.
Титрование слабого основания сильной кислотой. До ТЭ рН рассчитывают по формуле буферной смеси, где Ка – константа кислотности кислоты, сопряженной с титруемым основанием
[H+]=K0 =Ka
В ТЭ источником ионов Н+ является сопряженная кислота
[H+]= ac0 и рН=1/2(рКа+рс0).
За ТЭ значение рН определяется только добавлением сильной кислоты
Lg[T]=lgcT+lg(f-1)
Так же как и кривая титрования слабой кислоты, эта кривая несимметрична, а ТЭ не совпадает с точкой нейтральности
Кривые титрования кислот основаниям и оснований кислотами.
Кривые кислотно - основного титрования выражают зависимость изменения рН раствора от объема добавленного титранта. При расчете рН необходимо знать состав титриметрической смеси. Для упрощения вычислений ( что не приводит к заметным ошибкам ) не учитывают разбавление раствора в процессе титрования и используют понятие “концентрация”,а не “активность”. “Кривые титрования” предствляют в виде графика зависимости изменения рН от объема добавленного титранта или объема избытка определяемого вещества и избытка титранта.
В начале титрования рН изменяется очень медленно. Кривая показывает, в частности, что если оттитровать половину имеющегося количества кислоты, рН раствора изменится всего на 0,3 единицы по сравнению с исходным, если оттитровать 90%, то и тогда уменьшение рН составит лишь одну единицу. С уменьшением концентрации оставшейся кислоты изменение рН при титровании становится более резким. Оттитровывание кислоты от 90до 99% вызывает изменение рН уже на единицу. Также на единицу возрастает рН при оттитровывании от 99 до 99,9%, т.е. на 0,9%. Титрование последней 0,1% кислоты приводит к изменению рН на целых 3 единицы. Введение избытка в 0,1% NaOH по сравнению с эквивалентным количеством вызывает изменение рН также на 3 единицы, и рН раствора становится равным 10,0.
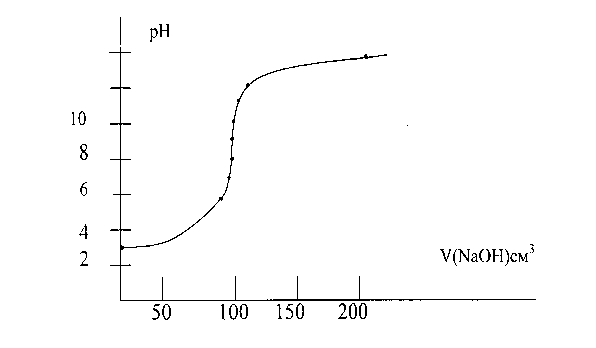
Кривая титрования сильного основания сильной кислотой представляет собой зеркальное изображение кривой титрования сильной кислоты сильным основанием. до точки эквивалентности рН раствора определяется концентрацией неоттитрованной щелочи, а после точки эквивалентности – концентрацией добавленной кислоты. В точке эквивалентности раствор нейтрален. Величина скачка и его положение на кривой титрования сильной кислоты сильным основанием.
Скачок титрования – резкое изменение рН в области точки эквивалентности.
