
14. Понятие внутренней энергии идеального газа
Определение. Внутренней энергией какого-либо тела называется энергия этого тела за вычетом кинетической энергии тела как целого и потенциальной энергии тела во внешнем поле сил. Для идеального газа внутренняя энергия состоит из суммы энергий поступательного, вращательного и колебательного движений молекул.
Вся
внутренняя энергия идеального газа
определяется кинетической энергией
беспорядочного движения его
молекул.
Внутреннюю
энергию одного моля идеального газа
найдём, умножив число Авогадро на
среднюю энергию одной молекулы:

Учитывая,
что
 ,
получим:
,
получим:

внутренняя энергия идеального газа является функцией температуры и пропорциональна ей, а также зависит от числа степеней свободы молекул.
Изменение
внутренней энергии идеального газа
равно
![]() ,
т.е. определяется температурами
начального и конечного состояний газа
и не зависит от процесса.
,
т.е. определяется температурами
начального и конечного состояний газа
и не зависит от процесса.
1![]() 6.
Первое
начало термодинамики. Все частные
случаи.
Изменение внутренней энергии системы
при переходе её из одного состояния в
другое равно сумме работы внешних сил
и количества теплоты, переданного
системе, то есть, оно зависит только от
начального и конечного состояния
системы и не зависит от способа, которым
осуществляется этот переход. Это
определение особенно важно для химической
термодинамики[2] (ввиду
сложности рассматриваемых процессов).
Иными словами, внутренняя
энергия является функцией состояния.
В циклическом процессе внутренняя
энергия не изменяется.
Рассмотрим
несколько частных случаев: Если
6.
Первое
начало термодинамики. Все частные
случаи.
Изменение внутренней энергии системы
при переходе её из одного состояния в
другое равно сумме работы внешних сил
и количества теплоты, переданного
системе, то есть, оно зависит только от
начального и конечного состояния
системы и не зависит от способа, которым
осуществляется этот переход. Это
определение особенно важно для химической
термодинамики[2] (ввиду
сложности рассматриваемых процессов).
Иными словами, внутренняя
энергия является функцией состояния.
В циклическом процессе внутренняя
энергия не изменяется.
Рассмотрим
несколько частных случаев: Если ![]() ,
то это означает, что тепло к
системе подводится.
Если
,
то это означает, что тепло к
системе подводится.
Если ![]() ,
аналогично — тепло отводится.
Если
,
аналогично — тепло отводится.
Если ![]() ,
то система не обменивается теплом с
окружающей средой и называется адиабатически
изолированной.
,
то система не обменивается теплом с
окружающей средой и называется адиабатически
изолированной.
17.
уравнением
Майера
Для
любого идеального
газа справедливо соотношение Майера:
![]() ,
где
,
где ![]() — универсальная
газовая постоянная,
— универсальная
газовая постоянная, ![]() —
молярная теплоёмкость при
постоянном давлении,
—
молярная теплоёмкость при
постоянном давлении, ![]() —
молярная теплоёмкость при постоянном
объёме. Уравнение Майера вытекает
из первого
начала термодинамики, примененного к
изобарному процессу в идеальном газе:
—
молярная теплоёмкость при постоянном
объёме. Уравнение Майера вытекает
из первого
начала термодинамики, примененного к
изобарному процессу в идеальном газе:
![]() ,
,
18.Адиаба́тный
проце́сс — термодинамический
процесс в
макроскопической системе, при котором
система не обменивается тепловой
энергией с
окружающим пространством
![]() где
где ![]() — давление газа,
— давление газа, ![]() —
малое приращение объёма.
—
малое приращение объёма.
19. Тепловые и холодильные машины. Второй закон термодинамики.Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая, что коэффициент полезного действия не может равняться единице, поскольку для кругового процесса температура холодильника не может равняться абсолютному нулю (невозможно построить замкнутый цикл, проходящий через точку с нулевой температурой).
20. Обратимые и необратимые процессы
Процесс наз. обратимым, если он допускает возвращение рассматриваемой системы из конечного состояния в исходное через ту же последовательность промежут. состояний, что и в прямом процессе, но проходимую в обратном порядке. При этом в исходное состояние возвращается не только система, но и среда. Обратимый процесс возможен, если и в системе, и в окружающей среде он протекает равновесно. При этом предполагается, что равновесие существует между отдельными частями рассматриваемой системы и на границе с окружающей средой. Обратимый процесс - идеализир. случай, достижимый лишь при бесконечно медленном изменении термодинамич. параметров. Скорость установления равновесия должна быть больше, чем скорость рассматриваемого процесса. Если невозможно найти способ вернуть и систему, и тела в окружающей среде в исходное состояние, процесс изменения состояния системы наз. необратимым.
21.Цикл Карно́ — идеальный термодинамический цикл. Тепловая машина Карно, работающая по этому циклу, обладает максимальным КПД из всех машин, у которых максимальная и минимальная температуры осуществляемого цикла совпадают соответственно с максимальной и минимальной температурами цикла Карно. Одним из важных свойств цикла Карно является его обратимость: он может быть проведён как в прямом, так и в обратном направлении. Количество теплоты, полученное рабочим телом от нагревателя при изотермическом расширении, равно
![]() Аналогично,
при изотермическом сжатии рабочее тело
отдало холодильнику
Аналогично,
при изотермическом сжатии рабочее тело
отдало холодильнику
![]() Отсюда коэффициент
полезного действия тепловой
машины Карно равен
Отсюда коэффициент
полезного действия тепловой
машины Карно равен
![]() .
.
22.
неравенством
Клаузиуса
Энтропия замкнутой системы не убывает:
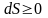 причём
причём
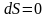 для обратимых процессов и
для обратимых процессов и
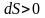 для необратимых.
для необратимых.
Соотношение называется неравенством Клаузиуса и представляет собой одну из формулировок второго начала термодинамики: энтропия замкнутой системы остаётся постоянной, если в ней происходят только обратимые процессы, и возрастает в случае необратимых процессов.
вывод:
![]()
![]()
![]()
![]()
![]()
23.
Энтропия.
Термодинамич состояния системы.
Изменение
энтропии термодинамической
системы при обратимом
процессе это
отношение общего количества
тепла ![]() к
величине абсолютной
температуры
к
величине абсолютной
температуры ![]() (то
есть тепло, переданное системе, при
постоянной температуре):
(то
есть тепло, переданное системе, при
постоянной температуре):![]() .
.
24.Второе начало термодинамики, определяющее направление тепловых процессов в изолированных системах: При любых происходящих в изолированной системе тепловых процессах система стремится к равновесному состоянию, при этом энтропия системы возрастает и достигает максимального значения в тепловом равновесии.Или : В изолированной системе энтропия не убывает
24.Второе начало термодинамики, определяющее направление тепловых процессов в изолированных системах: При любых происходящих в изолированной системе тепловых процессах система стремится к равновесному состоянию, при этом энтропия системы возрастает и достигает максимального значения в тепловом равновесии.Или : В изолированной системе энтропия не убывает
