
- •Методическая разработка
- •1) Знать:
- •4.2.1. Никотиновая кислота и ее производные.
- •4.4. Шестичленные гетероциклы с двумя атомами азота
- •4.4.1. Гидроксипроизводные пиримидина
- •4.4.2. Гидроксипроизводные пурина
- •Гипоксантин
- •4.5. Понятие об алкалоидах
- •5. Практическая часть
- •Перечень соединений, формулы которых необходимо знать:
Министерство здравоохранения Республики Беларусь
Учреждение образования
«Гомельский государственный медицинский университет»
Кафедра общей и биоорганической химии
Обсуждено на заседании кафедры ___________________
Протокол №_____________________________________
Методическая разработка
для проведения занятия со студентами
I курса лечебного факультета по биоорганической химии
Тема № 11: Биологически активные гетероциклические соединения
Время: 3 часа
1. УЧЕБНЫЕ И ВОСПИТАТЕЛЬНЫЕ ЦЕЛИ:
Сформировать знания строения, реакционной способности и методов получения in vitro и in vivo важнейших представителей лекарственных соединений и физиологически активных гетероциклических соединений.
МОТИВАЦИЯ ДЛЯ УСВОЕНИЯ ТЕМЫ:
Гетерофункциональные соединения гетероциклического ряда являются родоначальниками важнейших групп лекарственных и физиологически активных веществ.
ТРЕБОВАНИЯ К ИСХОДНОМУ УРОВНЮ ЗНАНИЙ:
а) сопряжение и ароматичность;
б) реакции электрофильного замещения в ароматических системах;
в) химические свойства гидроксильной, карбонильной, карбоксильной и аминогрупп;
г) кислотность и основность органических соединений;
д) строение гетероциклических соединений: фурана, пиррола, пиразола, имидазола, пиридина, пиримидина, пурина. Электронное строение пиридинового и пиррольного атомов азота;
е) реакции электрофильного и нуклеофильного замещения;
ж) водородная связь;
з) таутомерия.
В результате проведения занятия студент должен:
1) Знать:
- строение, химические свойства и биологическую роль производных пиридина: никотиновой кислоты, никотинамида, тубазида и фтивазида;
- строение, химические свойства и биологическую роль производных имидазола: гистидина и гистамина;
- строение, химические свойства и биологическую роль производных индола: триптофана, гетероауксина, триптамина, серотонина;
- строение, химические свойства и биологическую роль производных пиразола: антипирина, амидопирина, анальгина;
- строение, химические свойства и биологическую роль производных барбитуровой кислоты и барбитуратов;
- строение, химические свойства и биологическую роль производных гидроксипроизводных пурина: гипоксантина, ксантина, мочевой кислоты, алкалоидов.
2) уметь:
- составлять структурные формулы пяти- и шестичленных гетероциклических соединений с одним и двумя атомами азота в цикле: пиррола, имидазола, пиразола, пиридина, пурина, индола;
- составлять уравнения реакций получения их биологически активных производных: никотиновой кислоты и никотинамида, тубазида и фтивазида, гистидина и гистамина, триптофана, триптамина и серотонина, антипирина, амидопирина, анальгина, гипоксантина, ксантина и мочевой кислоты.
2. СВЯЗЬ СО СМЕЖНЫМИ ДИСЦИПЛИНАМИ:
Полученные знания о строении и реакционной способности гетерофункциональных производных физиологически активных производных гетероциклического ряда будут востребованы при изучении курсов биохимии, общей и клинической фармакологии, нормальной и патологической физиологии, мед. биологии, клинических дисциплин.
3. КОНТРОЛЬНЫЕ ВОПРОСЫ ПО ТЕМЕ ЗАНЯТИЯ:
3.1 Пиридин и его производные: никотиновая кислота и ее амид. Производные изоникотиновой кислоты как лечебные препараты (тубазид, фтивазид).
3.2 Имидазол, его производные: гистидин, гистамин. Биологическое значение.
3.3 Индол и его производные: скатол, гетероауксин, триптофан. Пути метаболизма триптофана. Биологическая роль серотонина.
3.4 Пиразол и его производные как основа ненаркотических анальгетиков (антипирин, амидопирин).
3.5 Барбитуровая кислота. Кето-енольная и лактам-лактимная таутомерия. Лечебные препараты производные барбитуровой кислоты.
3.6 Пурин. Гидрокси-производные пурина: гипоксантин, ксантин, мочевая кислота. Лактам-лактимная и прототропная таутомерия.
3.7 Метилированные производные ксантина: теофиллин, теобромин, кофеин.
4. Ход занятия:
4.1. Пятичленные гетероциклы с одним атомом азота
Пиррол – π-избыточное ароматическое соединение, для него в большей степени характерны реакции SЕ, которые протекают легче, чем у бензола, заместитель направляется преимущественно в α-положение.
Пиррол ацидофобен, в присутствии сильных минеральных кислот легко протонируется в α-положение, что приводит к потере ароматичности, дальнейшему осмолению или полимеризации.

Ацидофобность пиррола учитывается при выборе реагентов для SЕ, их проводят либо в щелочной среде, либо используют комплексы электрофильных реагентов с основаниями.
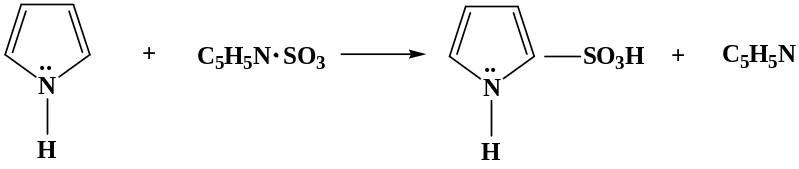
α-пирролсульфокислота
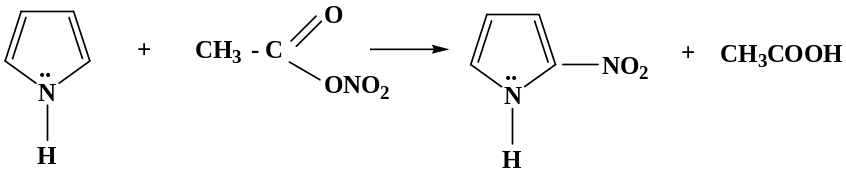
α-нитропиррол
Пиррол и его производные представляют интерес в виду того, что соединения, содержащие пиррольные ядра синтезируются в процессе жизнедеятельности животных и растений, применяются в медицине и фармацевтической промышленности.
4 пиррольных кольца образуют циклическую сопряженную систему порфин, которая входит в состав хлорофилла, гемоглобина и цитохромов. Порфиновое кольцо обладает высокой термодинамической устойчивостью, его энергия сопряжения ≈ 840 кДж/моль. Порфиновый цикл может содержать различные заместители. Порфин – плоскостная ароматическая система. В сопряжении участвуют 26 π-электронов.
Пиррол входит в состав конденсированной системы – бензопиррола (индол).

Индол – б/ц кристаллическое вещество, его циклическая система входит в состав многих природных веществ – аминокислот, алкалоидов и т.д.
Индол – ароматическое соединение, содержит 10 π-электронов, по химическим свойствам сходен с пирролом, но в отличие от него, реакции SЕ протекают по β-положению.
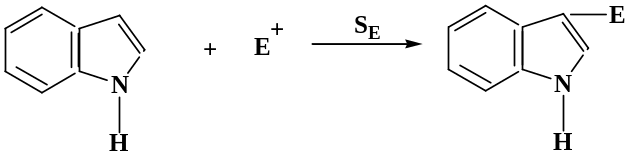
Индол относят как и пиррол к NН-кислотам, однако его кислотность выше, чем у пиррола, что связано с электроноакцепторными свойствами бензольного ядра.
Биологически важные производные индола
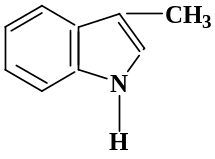 3-метилиндол
(скатол)
3-метилиндол
(скатол)
В живом организме образуется как конечный продукт азотистого обмена веществ.
 Индолил-3-уксусная
кислота
Индолил-3-уксусная
кислота
Кристаллическое вещество – природный гормон – стимулятор роста растений), оказывает стимулирующий эффект в малых дозах.
 Триптофан
Триптофан
Незаменимая L – (-) – аминокислота, необходимая для синтеза белков.
Продуктами биологического расщепления триптофана являются различные вещества: скатол, гетероауксин, триптамин – биогенный амин, серотонин – один из нейромедиаторов головного мозга, нарушение его обмена приводит к шизофрении и другим психическим заболеваниям.
4.2. Шестичленные гетероциклы с одним атомом азота

Пиридин Хинолин
Пиридин является π-недостаточной ароматической системой, максимальная электронная плотность сосредоточена на атоме азота, вследствие его высокой электроотрицательности. А электронная плотность в β-положениях выше, чем α-, это и объясняет его химические свойства.

Реакции SЕ протекают намного тяжелее, чем для бензола и преимущественно в β-положение

В связи с тем, в α-положениях значительно снижена электронная плотность, для пиридина возможны так же реакции, протекающие по механизму SN.

Пиридин и его гомологи также проявляют слабые основные свойства (близки по основным свойствам к третичным аминокислотам). Это связано с наличием атома азота как аммониевого центра. Он образует четвертичные соли с сильными кислотами.
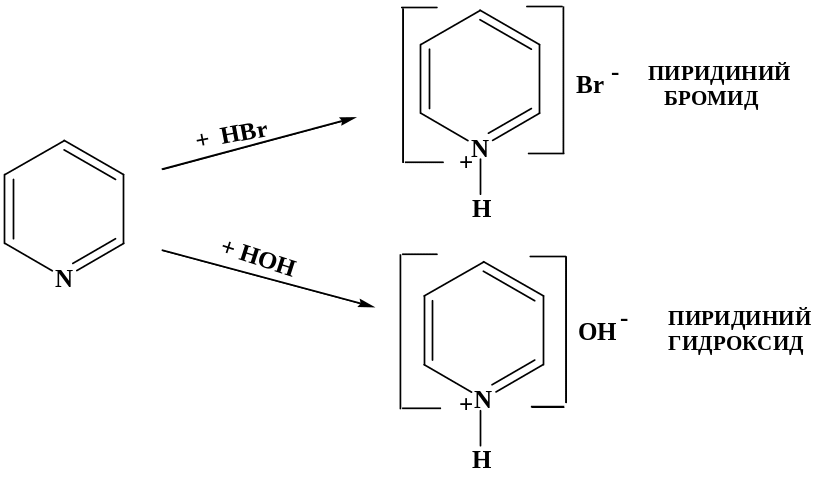
Пиридин также легко взаимодействует с галогеналкилами
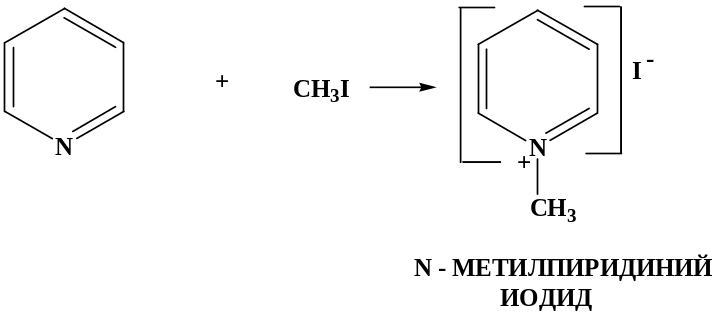
В соединениях типа N-метилпиридиний за счет положительно заряженного атома азота, гетероциклическое кольцо становится еще более электронодефицитным и поэтому чрезвычайно восприимчиво к нуклеофильной атаке.

Действие сильного нуклеофила – гидрид иона (Н‾) приводит к восстановлению

В 1.4-дигидро-N-метилпиридине нарушается ароматичность, молекула нестабильна и стремится за счет окисления перейти в ароматическое состояние.
Пиридиновое кольцо входит в состав НАД и НАДФ, в виде никотинамида, участвует в ОВ реакциях, протекающих в организме.
