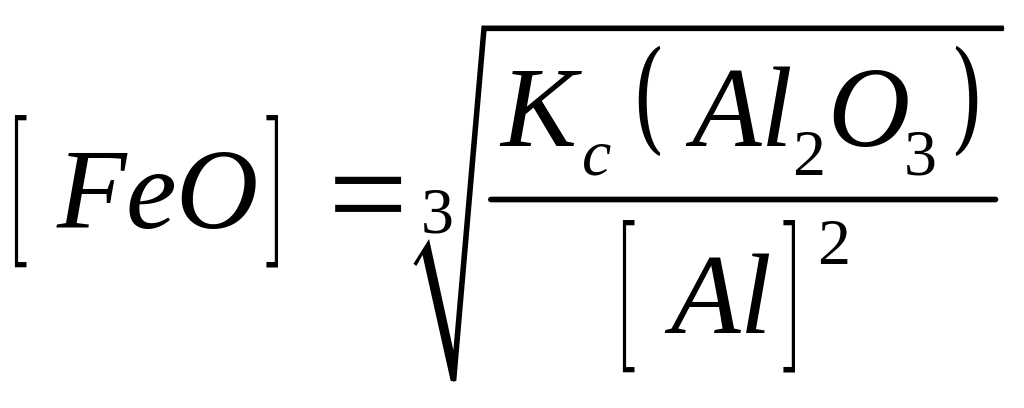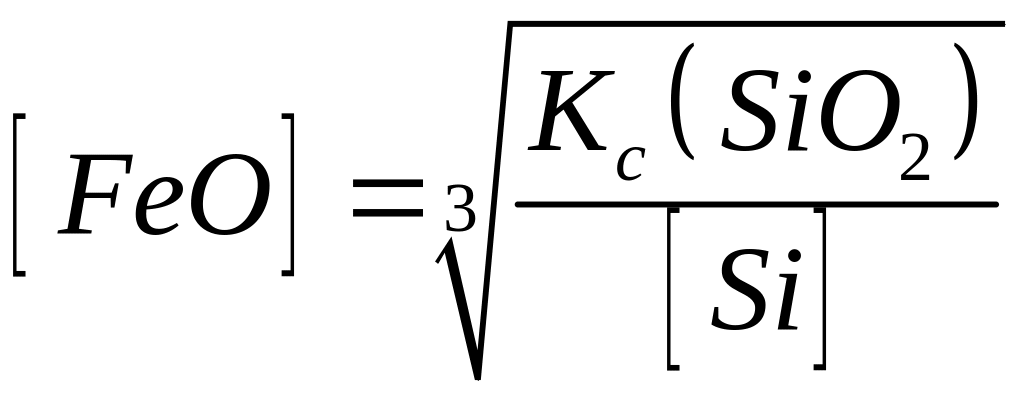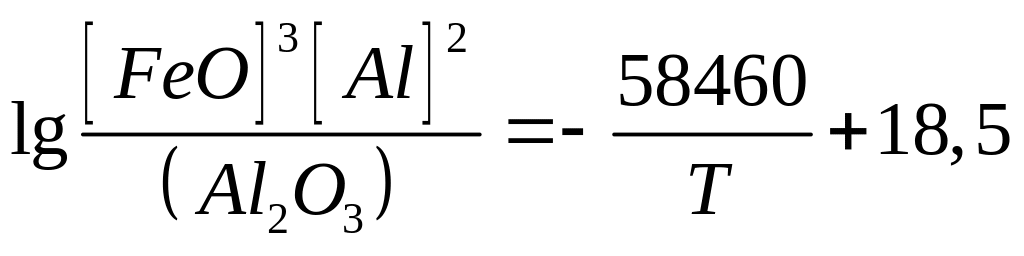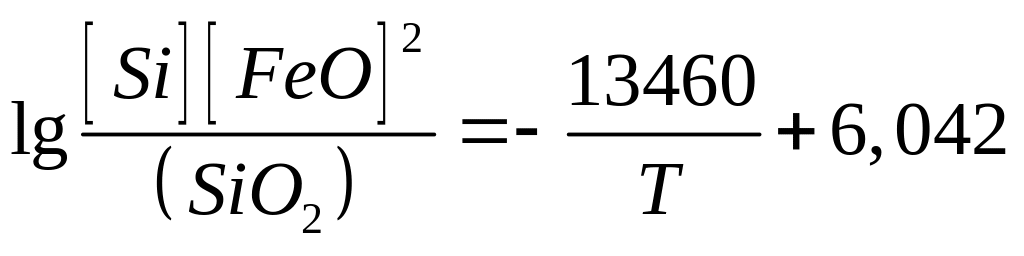Дифузійне розкиснення
Цей вид розкиснення базується на частковому переході закису заліза із рідкого металу в шлак, оскільки його розподіл між цими двома фазами підкоряється закону розподілу Нернста, тобто
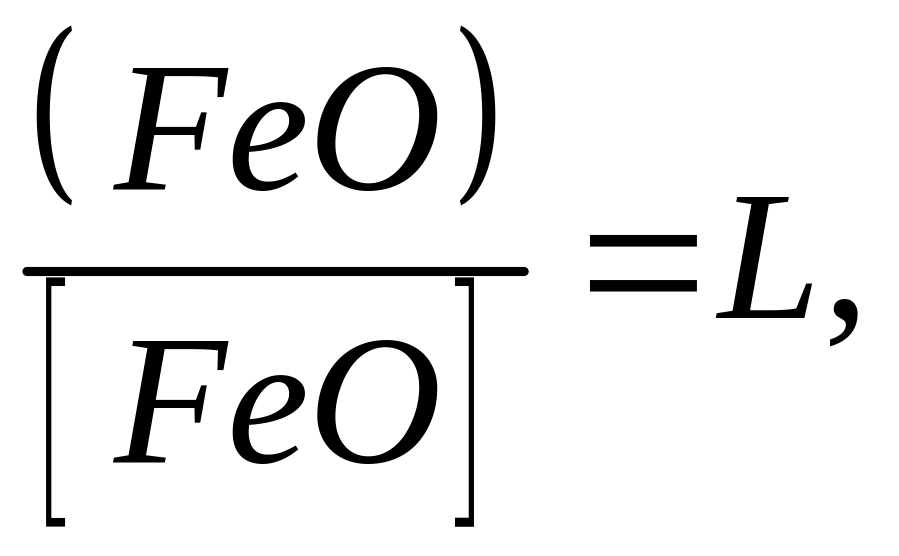 (222)
(8.8)
(222)
(8.8)
де L — константа розподілу.
Д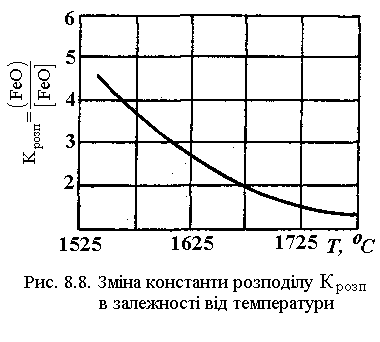 ля
цього виду розкислення важливо, щоб
концентрація вільного закису заліза в
шлаку зменшувалася; тоді нові порції
закису заліза будуть переходити з металу
в шлак.
ля
цього виду розкислення важливо, щоб
концентрація вільного закису заліза в
шлаку зменшувалася; тоді нові порції
закису заліза будуть переходити з металу
в шлак.
Зменшення вмісту вільного закису заліза в шлаку досягається різними шляхами:
а) зв'язуванням вільного закису заліза в комплексні сполуки кислими оксидами (утворення силікатів, титанатів);
б) проведенням розкиснюючих обмінних реакцій;
в) розведенням шлаків нейтральними в хімічному відношенні добавками.
Константа розподілу L, яка визначає собою ступінь переходу закису заліза з металу в шлак, залежить від температури. Зі збільшенням температури L зменшується, як видно з рис. 8.8. Це значить, що при високих температурах закис заліза може перейти з металу в шлак у меншій кількості, ніж при низьких.
При цьому виді розкиснення видалення закису заліза з металу в шлак відбувається шляхом дифузії, тому ванна рідкого металу спокійна, а всі хімічні процеси відбуваються на границі метал-шлак і в самому шлаку. Однак саме розкиснення іде повільно. Тому, хоча L при температурах, близьких до температури твердіння металу, має високі значення, швидкість дифузії сповільнюється і загальний ефект від розкиснення виявляється невисоким.
Процес дифузійного розкиснення найбільш помітний при утворенні краплі на електроді і її переносі, тому що йому сприяє більш висока температура, енергійне перемішування металу краплі і безупинний контакт свіжих порцій металу зі шлаком.
У зварювальній ванні дифузійне розкиснення іде повільно і лише у верхньому, тонкому шарі металу, що прилягає до шлаку.
Унаслідок відзначених особливостей дифузійне розкиснення в процесах зварювання звичайно не віграє значної ролі.
Розкиснення металу за допомогою кислих і основних шлаків
Розкиснення металу кислими й основними шлаками відбувається при контакті жужільної і металевої фаз як шляхом розкиснення на основі обмінних реакцій, так і дифузійного розкиснення.
Розкиснення металу за допомогою кислих шлаків. Розглянемо кислі шлаки, у яких є оксид кремнію. У таких шлаках спостерігається реакція зв'язування закису заліза в силікати заліза, нерозчинні в металі:
![]() ,
(223) (8.9)
,
(223) (8.9)
з
константою рівноваги реакції
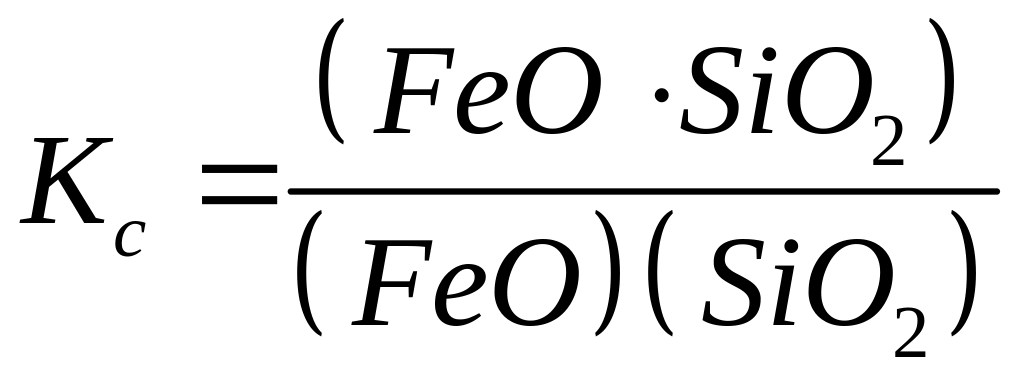 .
.
Зв'язування закису заліза в силікати викликає додатковий перехід закису заліза з металу в шлак. З виразу (8.8) випливає, що
![]() .
(224) (8.10)
.
(224) (8.10)
Якщо
рівняння
(8.10)
підставити у рівняння константи рівноваги
реакції
(8.9),
то одержимо
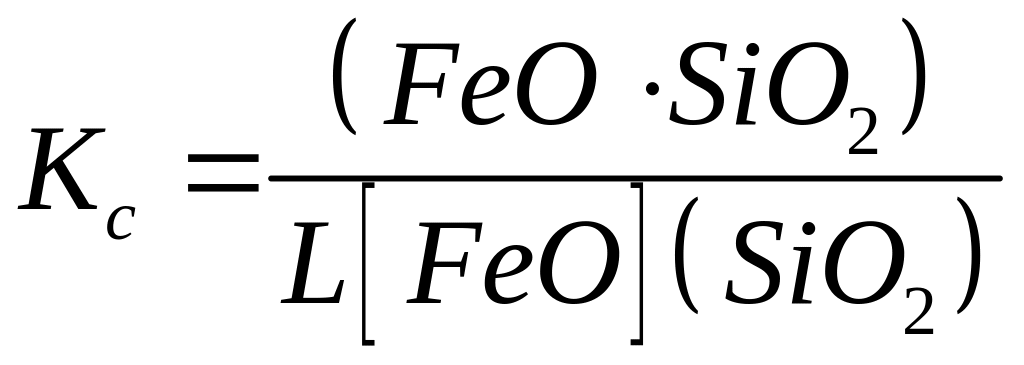 .
.
Вирішимо цю залежність відносно [FeО]:
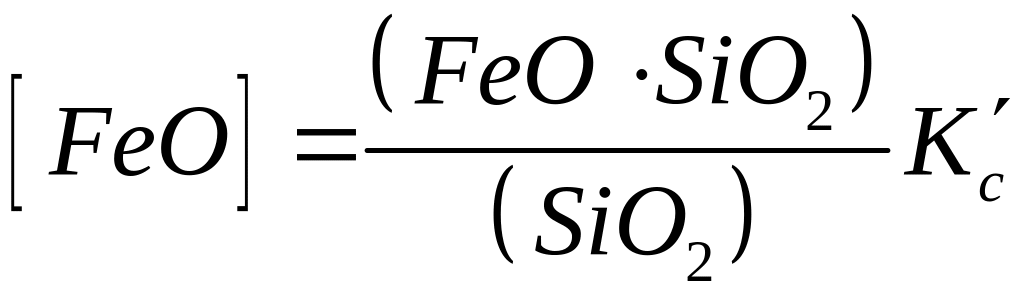 . (225)
(8.11)
. (225)
(8.11)
Таким чином, при використанні кислих шлаків для зменшення закису заліза в металі слід збільшити вміст кислого оксиду в шлаку (SiО2), тобто підвищити кислотність шлаку й одночасно зменшити кількість силікатів заліза, що утворяться в шлаку.
Однак підвищення змісту SiО2 у шлаку (п > 1,2) приводить до значного погіршення фізичних, а значить і технологічних, властивостей шлаку; шлак стає довгим, густим, його активність різко падає, порушується і стабільність процесу зварювання. Тому для збереження високої розкиснюючої здатності кислих шлаків доцільно:
а) замінити SiО2 двоокисом титана TiО2, цілком чи частково; таким шляхом удається зберегти потрібний ступінь кислотності шлаку, зробити його більш рідкотекучим і коротким, надати йому необхідну хімічну активність;
б) попутно вносити в такі шлаки елементи - розкиснювачі, що дають основні оксиди. Їхня роль зводиться до відновлення заліза із силікату і зменшення в шлаку вмісту (FeОSiО2).
Наприклад,
![]() .
.
Варто мати на увазі, що введення у шлак цих розкиснювачів зменшує кислотність шлаку.
Розкиснення металу за допомогою основних шлаків. В основних шлаках, на відміну від кислих, є надлишок основних оксидів, найбільш сильним з який є СаO. Тому такі шлаки не здатні до дифузійного розкиснення, оскільки наявні в них незначні кількості SiО2 (чи TiО2) одразу ж зв'язуються в комплексні сполуки із основними оксидами шлаку, тобто
![]() ,
(226) (8.12)
,
(226) (8.12)
і шлак не буде витягати FeО з металу.
Для розкиснення металу і збереження в ньому корисних легуючих елементів в основні шлаки вводять спеціальні добавки - розкиснювачі.
Розкиснювачі поводяться так само, як і при звичайному розкисненні металу, а продукти розкиснення переходять у шлак.
Отже, у загальному виді процес розкиснення металу пройде по реакції
![]() ,
,
з константою рівноваги
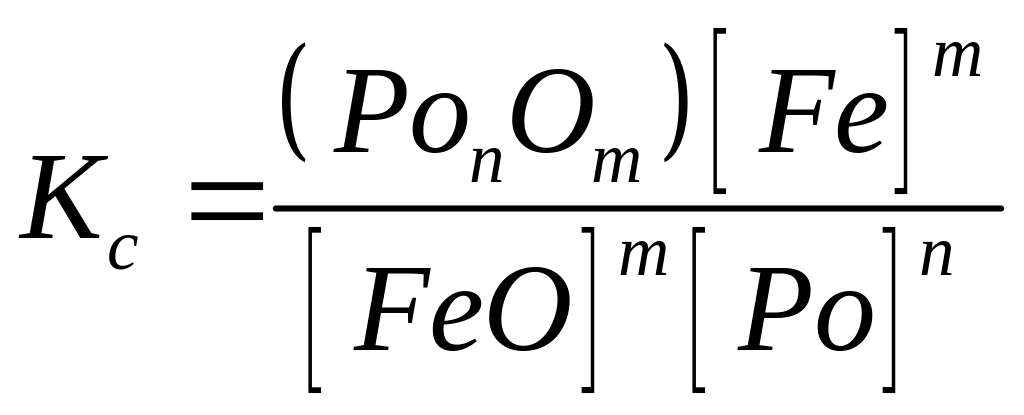 . (227)
(8.13)
. (227)
(8.13)
Вважаючи і тут, що у сталях [Fe] = 1, вирішуємо рівняння (8.13) відносно [FeО]. Тоді
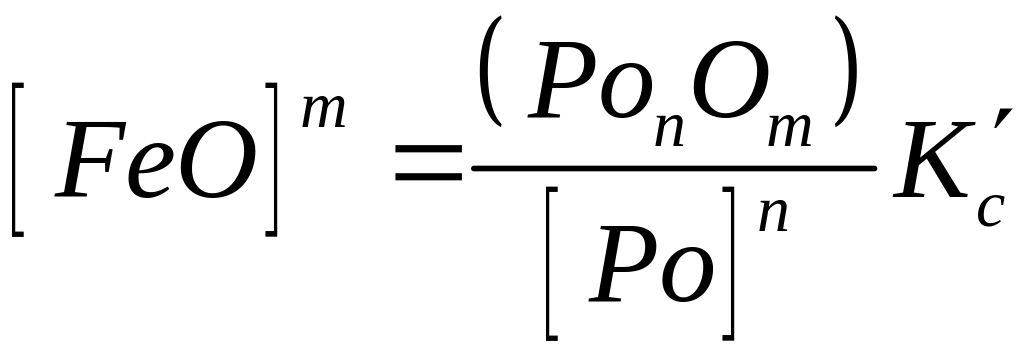
або
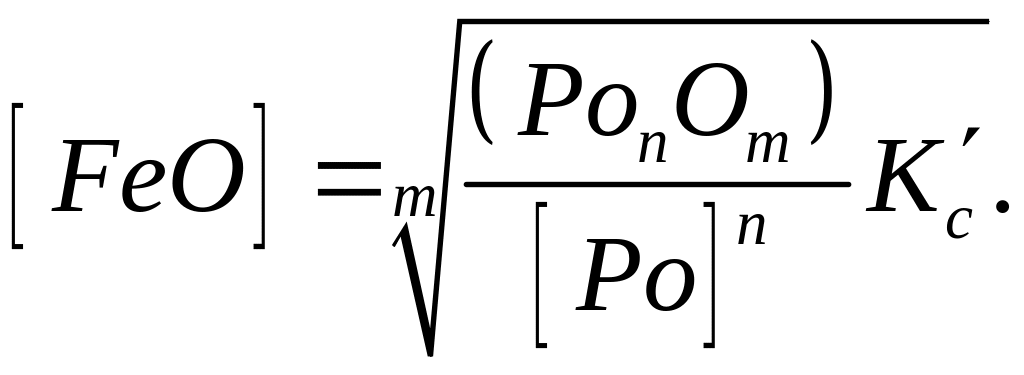 (228)
(8.14)
(228)
(8.14)
Щоб знизити вміст закису заліза в металі, необхідно збільшити у ньому кількість розкиснювача [Рo] і зменшити вміст оксиду розкиснювача в шлакові (РoпОт). Продукти розкиснення (PonOm) перейдуть у шлак. Збагачуючись цими оксидами, останній утрачає свою розкиснюючу здатність. Для підвищення розкиснюючої здатності такого шлаку необхідно:
а) обмежувати кількість розкиснювача, що вводиться. Для ефективності процесу розкиснення одночасно вноситься кілька розкиснювачів;
б) розбавляти шлаки спеціальними добавками, що зменшують у них вміст оксиду розкиснювача.
У табл. 8.2 наведено як приклад кілька розкиснювачів, реакції розкиснювання ними металу, рівноважні концентрації [FeО] і розрахункові рівняння константи рівноваги цих реакцій.
Таблиця 45 |
|||
Pозкиснювач |
Реакції |
Рівноважна концентрація |
Розрахункове рівняння константи рівноваги |
Al
Si
Mn
С |
|
|
|
Завдяки своїм фізичним властивостям основні шлаки забезпечують краще розкиснення металу, ніж кислі. Проведення розкиснюючих процесів хоча і знижує вміст кисню в металі до мінімуму, але не компенсує цілком утрату корисних елементів унаслідок їхнього часткового вигоряння і випаровування. Разом із тим розкиснення не дає можливості збагатити метал спеціальними легуючими елементами, щоб надати йому особливі властивості. Ці задачі виконуються іншою металургійною операцією,яка здійснюється одночасно з розкисненням металу — легуванням.