
Лекція 8
ВЗАЄМОДІЯ МІЖ РОЗПЛАВЛЕНИМ МЕТАЛОМ, ГАЗОВИМ СЕРЕДОВИЩЕМ І ШЛАКОМ (РОЗКИСНЕННЯ, ЛЕГУВАННЯ І РАФІНУВАННЯ МЕТАЛУ)
У зв'язку з можливим розвитком окисних процесів при зварюванні виникає необхідність розкиснення металу. Однак однієї операції розкиснення недостатньо для одержання наплавленого металу необхідного складу і властивостей, тому що метал утрачає деякі корисні домішки в результаті не тільки окиснювання, але і прямого випару під дією високих температур. Для компенсації цих утрат, а також для введення в наплавлений метал спеціальних добавок окремих елементів з метою підвищення якості металу, паралельно з розкисненням здійснюється і легування металу.
Нарешті, поряд з розкисненням і легуванням обов'язково робити рафінування металу, тобто очищення його від шкідливих домішок — сірки і фосфору, що попадають у метал зі шлаку,
Таким чином, взаємодія газової і жужільної фаз з рідким металом являє собою складний комплекс фізико-хімічних процесів, з яких найважливішими є реакції окиснювання, розкиснення, легування і рафінування металу.
Окисні процеси
Оксиди металу можуть бути розчинні чи нерозчинні в рідкому металі. У першому випадку вони утворять розчини з підвищеним змістом кисню, що різко погіршує якість металу.
Розчиняється в металі окисел заліза FeО, міді Cu2O, нікелю NiО, титана TiО2. У цьому випадку видалення залишків кисню з металу зв'язано з великими труднощами.
Нерозчинні в металі оксиди алюмінію Аl2О3, цинку ZnО, магнію MgО. Ці оксиди утворюють окрему фазу і порівняно легко видаляються в шлак, дозволяючи звести до мінімуму вміст кисню в металі. У залізі розчиняється його власний окисел FeО, інші ж оксиди, наприклад, MnО, SiО2, Al2O3, TiО2, у ньому практично не розчиняються.
Вуглець і водень, що знаходяться в металі, дають газоподібні оксиди, нерозчинні в рідкому металі і здебільшого встигаючі покинути метал до затвердіння (СО, Н2О). Однак при відомих умовах частина їх може залишитися в металі і викликати пористість.
Можливі наступні три основні види окиснювання складових металу і шлаку:
1) пряме окиснювання;
2) окиснювання нижчих оксидів до вищих оксидів;
3) окиснювання на основі обмінних реакцій.
Пряме окиснювання в загальному виді може бути представлено реакцією
![]() .
(215) (8.1)
.
(215) (8.1)
У цьому випадку здійснюється безпосереднє окиснювання металу вільним киснем з утворенням відповідного оксиду. Більшість таких процесів супроводжується виділенням тепла, тобто екзотермічно.
Постачальником вільного кисню в зону зварювання, крім повітряної атмосфери, може служити двоокис вуглецю CO2, пари води, карбонати, вищі оксиди, що дисоціюють при нагріванні і виділяють вільний кисень.
Однак варто пам'ятати, що всі реакції, що йдуть з виділенням тепла, у тому числі й окисні, при високих температурах протікають в'яло.
Процеси прямого окиснювання можуть спостерігатися і на поверхні відкритої зварювальної ванни. Тут інтенсивність окисних реакцій значно вища, чому сприяє їхній екзотермічний характер.
Окиснювання на основі обмінних реакцій представляється в загальному виді наступним рівнянням:
![]() ,
(216) (8.2)
,
(216) (8.2)
де Me1 і Ме2 — метали.
Істотний вплив на напрямок реакції (8.2), крім зовнішніх умов, справляють концентрація реагуючих речовин і спорідненість елементів до кисню.
Види процесів розкиснення
Розгляд обмінних реакцій типу (8.2) дозволяє висновок, що стосовно металу такі реакції можуть мати не тільки окисний, але і відновний характер (якщо реакція зсувається вліво). Для цього варто застосовувати елементи, що мають підвищену спорідненість до кисню й у даних умовах здатні енергійно зв'язувати кисень, звільняючи метал з оксиду. Такі елементи називаються розкиснювачами, а сам процес відновлення металу з оксиду — розкисненням.
Крім розкиснення дією розкиснювачів існує особливий процес — дифузійне розкиснення, на якому ми окремо зупинимося далі.
Розглянемо процеси розкиснення на прикладі сталей, де результатом окисних процесів є утворення розчинного в металі оксида FeО.
Розкиснення з одержанням конденсованих продуктів реакції
При цьому виді розкиснення процес супроводжується утворенням конденсованих оксидів, нерозчинних у металі і спливаючих у шлак. До числа розкиснювачів, що утворять такі оксиди, відносяться титан, кремній, марганець, алюміній і ін.
У загальному виді реакція розкиснення заліза представляється наступним рівнянням:
![]() , (217)
(8.3)
, (217)
(8.3)
де Pо
—
розкиснювач. Константа рівноваги реакції
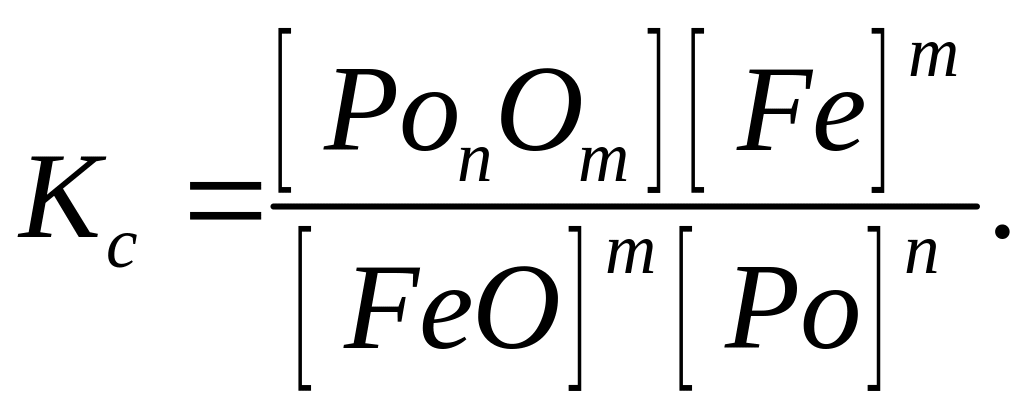 Але в сталях
[Fe]
≈
1,
тому рівноважна концентрація вільного
закису заліза в металі
Але в сталях
[Fe]
≈
1,
тому рівноважна концентрація вільного
закису заліза в металі
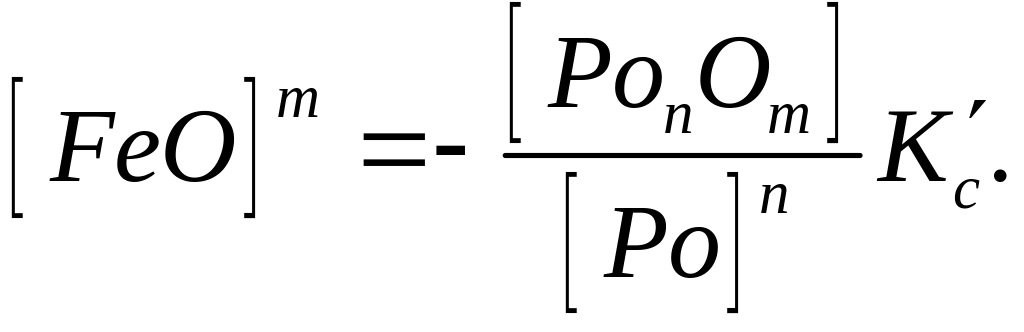
Отже, концентрація вільного закису заліза зменшується з підвищенням вмісту розкиснювача і при зменшенні оксидів даного розкиснювача в металі. Якщо ж врахувати, що розкиснювачами є, як правило, елементи, що утворюють нерозчинні в металі оксиди, які видаляються у шлак, то концентрацію [PonOm] можна вважати величиною постійною. Тоді, включаючи величину [PonOm] у константу рівноваги реакції, одержимо
 (218)
(8.4)
(218)
(8.4)
Таким чином, при певних температурах можна установити залежність між концентрацією розкиснювача і концентрацією вільного закису заліза, що знаходиться з ним в рівновазі; тоді, задаючись припустимим вмістом [FeО], визначають концентрацію, що відповідає цьому вмісту, розкиснювача в металі.
У табл. 8.1 приведені дані про найважливіші обмінні реакції розкиснення з одержанням конденсованих оксидів. Як видно з таблиці, ці процеси екзотермічні, тобто супроводжуються виділенням тепла.
Таблиця 8.1
Реакції |
Тепловий эфект, кал |
|
+187300 +62 994 -- +24 047 -- +35 8J5 |
Розглянемо характерні риси найбільш важливих розкиснювачів цієї групи, що застосовуються в зварювальній техніці.
а) Кремній — Si (Tпл = 1440 °С, Tкип = 2630 °С, густина γ= 2,37 г/см3). При окиснюванні утворює нерозчинний у металі кислий оксид SiО2, котрий легко створює комплекси, у тому числі і з FeО. Силікати заліза спливають на поверхню металу і переходять у шлак, унаслідок чого підвищується розкиснююча здатність кремнію.
Н а
рис. 8.1 показані ізотерми рівноваги між
кремнієм і закисом заліза. Як видно з
рисунка, з підвищенням концентрації
кремнію в металі зменшується вміст у
ньому закису заліза. При цьому розкиснююча
здатність кремнію помітно збільшується
зі зниженням температури. Оскільки
оксиди кремнію збільшують кислотність
шлаку, а разом з тим і його в'язкість,
уведення кремнію в зварювальну ванну
обмежують.
а
рис. 8.1 показані ізотерми рівноваги між
кремнієм і закисом заліза. Як видно з
рисунка, з підвищенням концентрації
кремнію в металі зменшується вміст у
ньому закису заліза. При цьому розкиснююча
здатність кремнію помітно збільшується
зі зниженням температури. Оскільки
оксиди кремнію збільшують кислотність
шлаку, а разом з тим і його в'язкість,
уведення кремнію в зварювальну ванну
обмежують.
б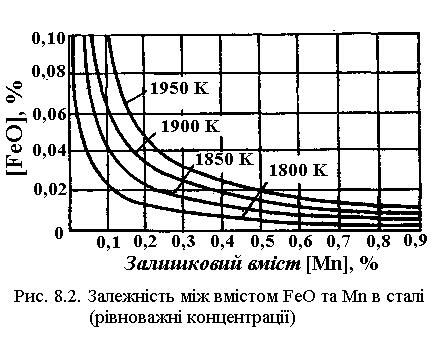 )
Марганець
-
Мn (Tпл
= 1244°
С, Tкип
= 2027°
С, густина γ
=
7,46
г/см3).
При окиснюванні марганець перетворюється
в закис МnО - відносно сильний основний
оксид, нерозчинний у металі. Закис
марганцю утворює із закисом заліза
безперервний ряд розчинів як у рідкому,
так і у твердому стані. Фізичне взаємне
розчинення закису заліза і закису
марганцю приводить до зменшення вмісту
в шлаку вільного закису заліза, і тому
створюються умови для відповідного
переходу з металу в шлак нових порцій
закису заліза.
)
Марганець
-
Мn (Tпл
= 1244°
С, Tкип
= 2027°
С, густина γ
=
7,46
г/см3).
При окиснюванні марганець перетворюється
в закис МnО - відносно сильний основний
оксид, нерозчинний у металі. Закис
марганцю утворює із закисом заліза
безперервний ряд розчинів як у рідкому,
так і у твердому стані. Фізичне взаємне
розчинення закису заліза і закису
марганцю приводить до зменшення вмісту
в шлаку вільного закису заліза, і тому
створюються умови для відповідного
переходу з металу в шлак нових порцій
закису заліза.
На рис. 8.2 показана залежність концентрації закису заліза від вмісту марганцю в сталі, що відповідає рівноважному стану при різних температурах. Так само як і для кремнію, зі збільшенням вмісту марганцю в металі зменшується концентрація в ньому закису заліза, однак вплив кремнію виявляється сильніше. З рисунка видно, що зі збільшенням температури дія марганцю як відновлювача слабшає.
в) Титан - Tі (Tпл = 1750° С, Tкип = 3400° С, густина γ= 4,54 г/см3) відноситься до числа сильних розкиснювачів, більш сильних, ніж кремній і марганець.
Кислий оксид ТіО2, що утворюється, нерозчинний в металі, легко вступає в комплекси, котрі переходять у шлак.
На рис. 8.3 зображена залежність між вмістом закису заліза і титана в металі, що відповідає рівноважним концентраціям, при температурі 1600° С. Тут також зі збільшенням вмісту титана зменшується кількість закису заліза.
Т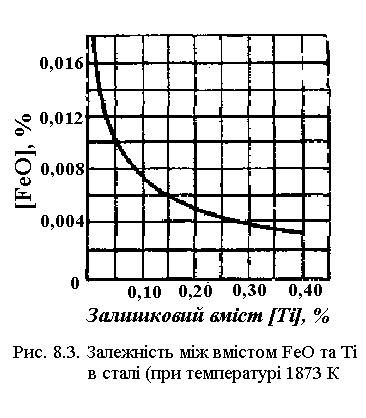 итан
активно реагує з азотом, утворюючи міцні
нітриди, нерозчинні в металі. Разом з
тим, він є сильним модифікатором, тобто
елементом, що сприяє подрібнюванню
зерна в металі.
итан
активно реагує з азотом, утворюючи міцні
нітриди, нерозчинні в металі. Разом з
тим, він є сильним модифікатором, тобто
елементом, що сприяє подрібнюванню
зерна в металі.
г) Алюміній — Аl (Тпл = 658° С, Ткип = 1800° С, густина γ = 2,7 г/см3) є найбільш сильним розкиснювачем цієї групи. Утворює амфотерний оксид Al2O3. Розкиснення рідкого металу алюмінієм супроводжується значним виділенням тепла, а це забезпечує додатковий підігрів металу зварювальної ванни, що благотворно впливає на перебіг процесів. Однак окис алюмінію погано спливає на поверхню зварювальної панни і частково залишається у шві у виді неметалічних вкраплень. Це є однією з причин незначного застосування алюмінію як розкиснювача при зварюванні сталей.
Як видно з рис. 8.4, розкиснююча здатність алюмінію є досить високою.
Алюміній, як і титан, схильний утворювати з азотом стійкі нітриди.
