
- •Избирательной
- •Молярной концентрацией
- •Массовой долей
- •108. При отборе первичной средней пробы учитывается принцип:
- •109.Аналитическая реакция,, происходящая только с открыванием ионом в присутствии других ионов называется:
- •159.Чтобы приготовить кислотный буфер с плавным изменением рН от его минимального до максимально возможных значений необходимо изменить:
- •160. Чтобы приготовить основной буфер с плавным изменением рН от его минимального до максимально возможных значений необходимо изменить:
159.Чтобы приготовить кислотный буфер с плавным изменением рН от его минимального до максимально возможных значений необходимо изменить:
* С к-ты
* С соли
* Ка
* + CHAn /CKtAn
* CH+
160. Чтобы приготовить основной буфер с плавным изменением рН от его минимального до максимально возможных значений необходимо изменить:
* Сосн
* С соли
* Кв
* + СKtOH / СKtAn
* COH-
161. Буферные растворы можно получить от их минимальных до максимально возможных
значений, изменяя только соотношение:
* + СHAn/CKtAn
* CAn/CKtOH
* CH+/COH-
* COH-/CH+
* CKtOH/CHAn
162. Чтобы рассчитать рН буферных систем , состоящих из слабой кислоты и ее соли необходимо
знать:
* aк-ты и СHAn/CKtAn
* + Kк-ты и СHAn/CKtAn
* Kк-ты CKtAn/СHAn
* h ст. гидролиза и СHAn/CKtAn
* h ст. гидролиза aк-ты
163. Какова размерность величины Ks?
* г-моль/л
* г/л
* г-моль/лn - где n-число ионов в молекуле
* г-моль/л 1/n - где n-число ионов в молекуле
* + это безразмерная величина
164. Если к смеси растворов КСl и К2 Cr O 4 в равных концентрациях (0.1 моль/л) по каплям
прилить раствор AgNO3, {Ks(Ag2CrO4 = 10-12, AgCl = 10-10}, то первым будет осаждаться:
* + Ag2CrO4
* AgCl
* осаждения не будет
* обе соли выпадут в осадок одновременно
* AgCl выпадет в осадок первым, но сразу же растворится
165. Акцептором электронов является:
* водород
* кислород
* среда
* восстановитель
* +окислитель
166. Как изменяется степень диссоциации CH3COOH в присутствии HCl?
* + увеличится
* уменьшится
* не изменится
* не имеет решения
* увеличится в два раза
167. Потенциал водородного электрода в растворе при рН = 1 и Т = 298 К равен:
* + 0 в
* 0,029в
* 0,029в
* -0,058в
*0,058в
168. На величину окислительно-восстановительного потенциала какой системы изменения рН раствора не оказывает влияние:
* Cr2O72-/2Cr3+
* MnO4-/Mn2+
* SO42-/H2S
* + Fe3+/Fe2+
* NO3-/NO
169.При каком соотношении концентраций окисленной и восстановленной форм значение
реального потенциала редокс пары Sn4+/Sn2+(E0 = +0,15* больше стандартного (Ер > E0)
* [Sn4+]/ [Sn2+] = 1:1
* [Sn4+]/ [Sn2+] = 1:10
* + [Sn4+]/[Sn2+] = 10:1
* [Sn4+]/ [Sn2+] = 2:3
* [Sn4+]/ [Sn2+] = 3:3
170.Изменения рН раствора не оказывает влияние на значение величины окислительно-
восстановительного потенциала систем:
* NO2-/NO
* AsO43-/AsO33-
* 2IO3-/ I2
* SO42-/ H2S
*+ I2/ 2I-
171. Величина реального потенциала системы Ag++е-->Ag0 будет определяться выражением:
* +E = E 0 + 0, 058 lg Пр
* E = E 0 - 0, 058 lg Пр
* E = E 0 + 0, 058 рПр
* E = E 0 - RT/nF 3,3 lg Пр
* E = E 0 + RT/F 3,3 ln Пр
172. Как изменится растворимость Ag2C2O4, если концентрацию ионов серебра над осадком увеличить в три раза?
* останется неизменной
* увеличится в три раза
* уменьшится в три раза
* + уменьшится в девять раз
* увеличится в девять раз
173. В 1л насыщенного водного раствора СаСО3 содержится 7*10-5 М соли.
Произведение растворимости соли равно:
* 2,3*10-8
* 7,5*10-3
* + 4,9*10-9
* 1,1*10-5
*6,5*10-7
174. Чтобы pH раствора уменьшить на единицу, концентрацию ионов водорода надо увеличить в:
* 0,1 раз
*+ 10 раз
* 14 раз
* 100 раз
* 1000 раз
175. Чему равна ионная сила 0,1М раствора BaCl2?
* + 0,3
* 0,6
* 0,9
* 0,1
* 1,0
176.Константы диссоциации уксусной, азотистой и хлоруксусной кислот равны соответственно
1,7*10-5, 5,1*10-4, 1,4*10-3. Выберите ряд соединений, расположенных в порядке возрастания
* HNO2, CH3COOH, CH2ClCOOH
* + CH3COOH, HNO2, CH2ClCOOH
* CH3COOH, CH2ClCOOH, HNO2
* HNO2, CH2ClCOOH, CH3COOH
* CH2ClCOOH, CH3COOH, HNO2
177.Какая из приведенных реакций является реакцией автопротолиза:
* CH3COO- + H2O =.CH3COOH+OH-
* NH3 + H2O = NH4++ OH-
* NH4++H2O =.NH3+H3O+
* + CH3COOH + CH3COOH =.CH3COO-+ CH3COOH2+
* NH4+ + CH3COOH = NH3 + CH3COOH2+
178. В каком случае можно ожидать разрушение комплекса при добавлении солей в разбавленный раствор [Ag(NH3)2]NO3
* KBrO3 Пр (AgBrO3) = 5,5 * 10-5
* KCl Пр (AgCl) = 1,6 * 10-10
* KBr Пр (AgBr) = 7,0 * 10-13
* +K2S Пр (Ag2S) = 6,3 * 10-50
* осадок не образуется ни в одном из случаев
179. Какой способ разложения комплексов наиболее эффективен для разрушения тиосульфатов?
* разбавление
* добавление воды
* + подкисление
* окисление
* восстановление
180. При добавлении избытка комплексующего реагента электролитическая диссоциация
комплексного иона:
* + уменьшится
* уменьшится , затем увеличится
* увеличится
* увеличится затем уменьшится
* не изменится
181.Какое из соединений серебра растворяется в аммиаке?
* +AgCl Пр (AgCl) = 1,6 * 10-10
* AgBr Пр (AgBr) = 7,0 * 10-13
* AgI Пр (AgI) = 1,0 * 10-16
* AgSCN Пр (AgSCN) = 1,0 * 10-12
* Ag2S Пр (Ag2S) = 6,3 * 10-50
182. Какое из веществ лучше выбрать для разрушения комплексного иона [Ag(NH3)2]+?
* NaCl Пр AgCl = 1,6*10-10
* NaBr Пр AgB r = 7,0*10-13
* + NaJ Пр AgJ = 1,0*10-16
* NaSCN Пр AgSCN = 1,0*10-12
* NaOH Пр AgOH = 2,0*10-8
183. В каком из 0,1 М растворов солей концентрация ионов [Cd2+] самая большая?
* [Cd(CN)4]2- Кнест=7,8*10-18
* [Cd(NH3)4]2- Кнест =2,8*10-7
* +[CdCl4]2- Кнест =2,0*10-2
* [CdJ4]2- Кнест =3,0*10-6
* [Cd(N2H4)4]2- Кнест =1,3*10-4
184. Какого типа связи существует между центральным атомом и лигандами в комплексных ионах?
* ионная
* ковалентная
* металлическая
* + донорно-акцепторная
* водородная
185.Комплексные соли в водных растворах диссоциируют по типу:
* сильных электролитов
* при первичной электролитической диссоциации ведут себя как слабые электролиты, а сами
комплексные ионы диссоциируют по типу сильных электролитов
* практически не диссоциируют
* + в процессе первичной электролитической диссоциации ведут себя как сильные
электролиты, а сами комплексные ионы диссоциируют слабо.
* ведут себя как слабые электролиты при диссоциации по первой и по второй ступени
186. Что произойдет если к раствору с осадком AgJ и AgCNS добавить раствор KBr
Пр(AgJ)=1*10-16 , Пр(AgCNS)=1.1*10-12, Пр(AgBr)=7.7*10-13?
* ничего не произойдет
* выпадает осадок AgBr, а AgJ растворится
* выпадает осадок AgBr, AgCNS растворится
* + выпадает осадок AgBr, AgJ и AgCNS растворится
* все осадки выпадут одновременно
187.Одинакова ли растворимость осадков Ag2CrO4, AgCNS, CdCO3, если их произведение
растворимости равны 1,1*10-12; 1,1*10-12; 2,1*10-12;
* растворимость Ag2CrO4 и AgCNS одинакова
* растворимость всех солей одинакова
* растворимость CdCO3 и Ag2CrO4 одинакова
* + растворимость CdCO3 и AgCNS одинакова
* растворимость всех солей разная
188. Произведение растворимости для соединения AmBn образующегося по уравнению
mA+nB<-->Am*Bn (т* описывается выражением:
* Пр= ([A]m*[B]n)/ [Am Bn]
* + Пр = [A]m*[B]n
* Пр = [A]m + [B]n
* Пр = m [A]*n [B]
* Пр = m [A] + n [B]
189.Укажите наиболее устойчивый комплексный ион:
* [Ag ( NH3 )2]+ , Kн = 5,7* 10-8
* [Zn ( NH3 )`4]2+, Кн = 3,5* 10 -10
* [Hg Cl4]2- , Kн = 8,5* 10 -16
* [Cd (CN)4]2- , Kн = 1,4 * 10 -19
* + [Cu (CN)4]2- , Kн = 5,0 * 10 -31
190.Для реакции протекающей в растворе аА+вВ = dД + еЕ константа скорости имеет вид:
*
Кс
=

*
+ Кс
=

*
Кс
=

*
Кс
=

*
Кс
=

200. Раствор уксусной кислоты с молярной концентрацией эквивалента 0,01 моль/л и степенью
диссоциации
 = 0,01 имеет значение pН
равным:
= 0,01 имеет значение pН
равным:
* 11
* 12
* 2
* 3
* + 4
201.Реакция, которая позволяет обнаруживать ион в смеси с другими ионами называется:
селективной
+ специфичной
избирательной
действием группового реагента
ионно-обменной
202. Определенная последовательность реакции обнаружения отдельных ионов называется:
дробным методом анализа
+ систематическим анализом
действием группового реагента
реакциями отделения
пробой на полноту осаждения
203.Показатель ионного произведения воды при250С равен:
1*10-14
1*10-7
7
+ 14
1*1014
204. При отборе первичной средней пробы учитывается принцип:
партия вещества размельчается, перемешивается и средняя проба берется из центральной точки
средняя проба берется из любой точки
средняя проба составляется из точек по диагонали
+ средняя проба составляется из порций, взятых из разных точек
средняя проба составляется из порций, взятых из четырех точек по краям
205.Аналитическая реакция,, происходящая только с открыванием ионом в присутствии других ионов называется:
избирательной
+ специфической
гомогенной
гетерогенной
каталитической
206.Чтобы приготовить кислотный буфер с плавным изменением рН от его минимального до максимально возможных значений необходимо изменить:
С к-ты
С соли
Ка
+ CHAn /CKtAn
CH+
207.Чтобы приготовить основной буфер с плавным изменением рН от его минимального до максимально возможных значений необходимо изменить:
Сосн
С соли
Кв
+ СKtOH / СKtAn
COH-
208.При разделении ионов по сероводородному методу используют классификацию:
фосфатную
сульфатную
аммиачно-фосфатную
+ сульфидную
кислотно-основную
209.По какой формуле рассчитывают [H+] для водных растворов NH4OH, если K(NH4OH) = 1,8*10-5:
+ [H+] = Kw/KNH4OH * CNH4OH
[H+] = Kw/ CNH4OH
[0H-] = CNH4OH
pH = 14+lg CNH4OH
pH = 14-lg CNH4OH
210. Какую формулу можно использовать для расчета растворимости осадка типа A3B в воде?
*+
*
*
*
*
211. Катионы Сa2+ Ba2+ Sr2+ объедены в одну группу по кислотно-основной схеме анализа на основании того что:
хроматы нерастворимы в воде
сульфаты нерастворимы в воде
карбонаты нерастворимы в воде
карбонаты растворимы в минеральных кислотах
+ сульфаты нерастворимы в минеральных кислотах
212.Белый осадок сульфата бария нерастворим в минеральных кислотах переводят его в растворимое состояние сплавляя с:
+ содой
хлоридом натрия
хлоридом калия
хлоридом кальция
хлоридом стронция
213.Бромид – ион в кислой среде окисляется бромат-ионом до:
+ свободного брома
брома(IУ)
брома (УII)
брома (III)
брома (II)
214. Продуктом реакции бромата калия и иодида натрия в кислой среде является:
+ свободный иод
бромид натрия
иод(+4)
бром(+4)
иод(+5)
215.Водные растворы тетрабората натрия вследствие реакции гидролиза имеют среду:
сильнокслую
слабокислую
нейтральную
слабощелочную
+ сильнощелочную
216.Аммиачный раствор соли меди окрашен:
в розовый цвет
красный
зеленый
желтый
+ синий
217.Как избирательно осадить SO42- ионы из смеси анионов SO42-, S2O32-, PO43-?
солями бария
солями стронция
+ солями бария и затем обработать полученный осадок HCl
восстановить цинком до SO2 в кислой среде
солями кальция
218. Раствор соли железа (III) окрашен:
в зеленый цвет
красный
+ соломенный
голубой
синий
219.Тиосоль - это соединение состава:
H2S
SnS
SnS2
+
220.Ионы никеля при систематическом анализе открывают реактивом:
Ильинского
+ Чугаева
Ринмана
Фишера
Тенарова
221.Аммиачный комплекс соли кобальта окрашен в:
зеленый цвет
красный
фиолетовый
+ желто-бурый
Черный
222. Редокс пара – это система, состоящая из:
* + окисленной и восстановленной форм данного вещества
* ионов водорода
* гидроксид - ионов
* только из окислителя
* только из восстановителя
223.Система находится в состоянии устойчивого химического равновесия, если значение Е0 равно:
* Е > 0
* Е < 0
* + Е = 0
* E = max
* E = min
224.Глубина протекания окислительно-восстановительной реакции определяется величиной
Е0 (ЭД* по формуле:
*

*
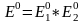
*

*

*
+
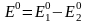
225.Степень
окисления центрального иона в соединении
 равна:
равна:
* + 3 +
* 2 +
* 0
* 2 -
* 3 –
226.Степень
окисления центрального иона в соединении
 равна:
равна:
* + 3+
* 2+
* 0
* 2–
* 3–
227.Трихлориду пентаамминхлорплатины (IV) соответствует химическая формула:
*

*

*
+

*

*

228.
Назовите соединение

* гексахлороплатинат (IV) натрия
* амминпентахлороплатинат (IV) натрия
* хлорид пентаамминхлоро платина (IV)
* + хлорид триамминхлороплатины (II)
* диаминтетрахлороплатина
229. Наиболее устойчивый комплексный ион это:
*
 Кн
= 5,7 * 10-8
Кн
= 5,7 * 10-8
*
 Кн
=
3,5 * 10-10
Кн
=
3,5 * 10-10
*
 Кн
= 8,5 * 10-16
Кн
= 8,5 * 10-16
*
 Кн
= 1,4 * 10-19
Кн
= 1,4 * 10-19
*
+
 Кн
= 5,0 * 10 -31
Кн
= 5,0 * 10 -31
230. Для сильных электролитов характерно:
* >1
* <1
* + = 1
* = 0
* > 0
231. Для слабых электролитов характерно:
* > 1
* + < 1
* = 1
* = 0
* > 0
232. Взаимодействие всех ионов между собой в растворах сильных электролитов определяет величина:
* а
* f
* + I
* m
* Сlim
233. Произведение растворимости определяется величиной:
*
* Ка
* Кв
* + Кs
* m
234. Наиболее растворимым соединением в воде является вещество:
* + СаSO4 5*10-3
* SrSO4 5,66*10-4
* PbSO4 1,26*10-4
* BaCO3 1,05*10-5
* BaSO4 7,14*10-5
235. Наиболее трудно растворимым соединением в воде является вещество:
* AgCL Кs = 1,78*10-10
* Ag2MoO4 Кs = 2,8*10-12
* Ag2SO3 Кs = 1,5*10-14
* + Ag3PO4 Кs = 1,3*10-20
* Ag2SO4 Кs = 1,6*10-5
236. По значению величины рКs наиболее трудно растворимой солью в воде является осадок:
* AgBr 12,28
* + AgCN 15,84
* AgCL 9,75
* Ag2CrO4 11,95
* Ag2Cr2O7 10
237. Ионное произведение воды равно:
* + Kw = Ka*Kb
*
Kw =

* Kw = 1/2Ka*Kb
* Kw = Ka/Kb
* Kw = 2Ka*Kb
238. Коэффициент активности определяется по формуле:
* J = 1/2∑CiZi2
* K = K1/K2
* + f = a/c
* a = Сдисс/Собщ
* m = Clim.V`min.106
239. Каким будет раствор, если рН+рОН = 14?
* кислым
* щелочным
* слабокислым
* слабощелочным
* + нейтральным
240. Какова реакция среды, если СOH- = 10-13:
* щелочная
* слабощелочная
* нейтральная
* слабокислая
* + кислая
241. Ионное произведение воды при 25 0C равно :
* 1*1014
* + 1*10-14
* 1*107
* 1*10-7
* 14
242.Гидроксильным показателем рОН называют величину, равную:
* -lnCН+
* + -lgCОН--
* –lgCН+
* –lnCОН-
* 14
243.Для разбавленных растворов величина коэффициента активности имеет значение:
* f < 1
* +f = 1
* f > 1
* f = 0
* f < 0
244.Единицей измерения величины Umin является:
* моль/л
* моль
* мг
* + мл
* л
245. Ионная сила раствора содержащего 0,01моль/л CaCl2 равна:
* + 0,03
*0,06
*0,6
* 0,3
* 0,006
246. Растворимость солей AB2 равна 1*10-3 моль/л. Чему равна величина Ks?
*10-3
*+ 4*10-9
* 10-6
*3*10-6
* 4*10-6
247.Ks соли A2B3 равна 1,08.10-23. Чему равна растворимость ее в моль/л?
*2*10-23
* + 1*10-5
*1*10-3
* 1*10-7
*1*10-1
248. По какой из приведенных формул можно рассчитать ионную силу раствора:
* ∑CiZi
* 1/2∑CiZi
* 1/2∑Ci2Zi
* ∑CiZi2
* + 1/2∑CiZi2
249. Какая из приведенных частиц согласно протолитической теории играет роль основания:
* NH4+
* H3O+
* + HSO4-
* H2SO3
* H2SO4
250. Какая из приведенных частиц согласно протолитической теории играет роль кислоты:
* OH-
* + H3O+
* Cl-
* NH3
* SO42-
