
1 Вопрос
Основные стадии процесса на твердом катализаторе. Соотношение скоростей стадий и их влияние на общий результат процесса.
I – внешнее пространство,
II – внутри катализатора,
III – пространство, в котором другие концентрации участников процесса (диффузионный подслой)
R – концентрация аммиака
Каталитическе реакции на тв. катализаторе можно разбить на стадии:
д
 иффузионный
перенос реагента А к внешней поверхности
катализатора (внешняя диффузия).
иффузионный
перенос реагента А к внешней поверхности
катализатора (внешняя диффузия).Диффузионный перенос реагента А в поры катализатора к его внешней поверхности (внутренняя диффузия).
Адсорбция реагента А на внешней и внутренней поверхностях катализатора.
Поверхностная реакция с образованием активированного комплекса адсорбции.
Перегруппировка адсорбированных комплексов с образованием адсорбированных комплексов из продукта реакции и адсорбента.
Десорбция продуктов реакции с внутренней и внешней поверхности адсорбента (катализатора) с высвобождением активных центров на поверхности катализатора.
Диффузия продуктов из пор к внешней поверхности катализатора (обратная внутренняя диффузия).
Диффузия продуктов от внешней поверхности катализатора в поток (обратная внешняя диффузия).
С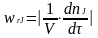 корость
(удельная скорость) химической реакции
wrJ - количество (моль) nJ
одного из реагентов или продуктов,
прореагировавших (или образовавшихся)
в единицу времени t
в единице реакционного пространства.
корость
(удельная скорость) химической реакции
wrJ - количество (моль) nJ
одного из реагентов или продуктов,
прореагировавших (или образовавшихся)
в единицу времени t
в единице реакционного пространства.
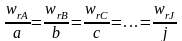
Из законов стехиометрии следует, что:
Р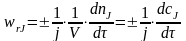 еальные
скорости образования веществ так
относятся друг к другу, как стехиометрическое
соотношение их коэффициентов.
еальные
скорости образования веществ так
относятся друг к другу, как стехиометрическое
соотношение их коэффициентов.
Кинетическое уравнение – зависимость скорости реакции от концентрации участников реакции
wrJ = wrJ(CJ1,CJ2….)
Взаимосвязь между скоростями отдельных стадий и общей скоростью процесса, состоящего из нескольких последовательных стадий, различна для нестационарного и стационарного режимов протекания этого процесса.
Скорости последовательных стадий в нестационарном режиме различаются между собой, а скорость процесса в целом равна скорости самой медленной стадии.
В стационарном режиме скорости отдельных последовательных стадий «подстраиваются» под скорость самой затрудненной стадии; они равны между собой и равны общей скорости процесса:
w1 = w2 = ... = wi = wS
В зависимости от соотношения потенциально возможных скоростей отдельных стадий можно говорить о возможном наличии лимитирующей стадии, или скорость-определяющей стадии.
ИНТЕГРАЦИЯ
1 Вопрос
Температурно- энтальпийная диаграмма и построение составной кривой.
Горячие потоки- потоки требующие охлаждения, холодные - нагревания.
Изменения теплосодержания энтальпии при охлаждении/ нагревании и изменения фазового состояния:

Зависимость энтальпии от температуры:

Изменение энтальпии потока при изменении температуры:
dH= CpMdT
Cp-удельная теплоёмкость, Дж/кгК
M-массовый расход, кг/с
T-температура, К
H- теплосодержание потока,Вт
Изменение теплосодержания технологического потока:
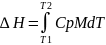
При постоянной теплоёмкости:
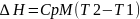
Потоковая теплоёмкоть: СР=СрМ
Потоковая теплоёмкость- количество энергии ,которое необходимо подвести к потоку, чтобы повысить температуру вещества, проходящее через поперечное сечение потока за одну секунду на один градус.
Совместное
построение температурно-энтальпийных
графиков технологических потоков
позволяет определить минимально
необходимое значение горячих утилит
QHmin
и
холодных утилит QСmin
для
каждого заданного значения
 Tmin..
,т.е.
существует корреляция между значениями
Tmin
и
QHmin
QСmin.
Tmin..
,т.е.
существует корреляция между значениями
Tmin
и
QHmin
QСmin.
Стоит отметить, что значение Tmin не может быть больше разности начальных температур горячего и холодного потока.
Если
к процессу подводить большую мощность,
то и отводить от него необходимо большую
мощность, т.е. QHmin
+х QСmin
+x.
QСmin
+x.
ЯВЛЕНИЯ ПЕРЕНОСА
