Необходимо дополнить перечень качественных реакций всех катионов и анионов
Ион |
Реагент |
Уравнение реакции |
Аналитический сигнал |
Катионы |
|||
K+ |
Na3[Co(NO2)6] |
2KCl+Na3[Co(NO2)6] K2Na[Co(NO2)6]↓+2NaCl Мешают ионы аммония, устранить их мешающее действие можно отгонкой солей аммония: NH4Cl
|
Желтый осадок |
окрашивание пламени |
|
Фиолетовый |
|
NH4+ |
NaOH |
NH4+ + OH– → NH3↑ + H2O |
посинение лакмусовой бумажки, запах аммиака |
реактив Несслера |
NH4+ + 2[HgI4]2– + 4OH– →
[ ]I↓ +7I– + 3H2O
|
бурый осадок |
|
Na+ |
(CH3COO)2UO2 |
CH3COONa + (CH3COO)2UO2 = CH3COONa·(CH3COO)2UO2 |
осадок зеленовато-желтого цвета и характерные тетраэдры и октаэдры |
окрашивание пламени |
|
Желтый |
|
Ag+ |
HCl |
Ag+ + Cl– → AgCl↓ AgCl↓ + HCl → HAgCl2 |
белый осадок, раство-рим в избытке HCl |
NH4OH |
AgCl↓ + 2NH3 → [Ag(NH3)2]Cl |
растворение осадка в аммиаке |
|
KI |
[Ag(NH3)2]Cl + KI → AgI↓ + 2NH3 + KCl |
желтый осадок |
|
Pb2+ |
HCl |
Pb2+ + 2Cl– → PbCl2↓ |
белый осадок, растворяется при нагревании |
KI |
Pb2+ + 2I– → PbI2↓ |
желтый осадок, реакция «золотого дождя» |
|
Ca2+ |
H2SO4 |
Ca2+ + SO42– + 2H2O → CaSO4·2H2O |
гипс, микрокристалло-скопическая реакция (звездочки) |
окрашивание пламени |
|
кирпично-красный |
|
Ва2+ |
H2SO4 |
Вa2+ + SO42– → ВaSO4↓ |
белый кристаллический осадок, не растворим в HCl, HNO3 |
окрашивание пламени |
|
Желто-зеленый |
|
Sr2+ |
H2SO4 |
Sr2+ + SO42– → SrSO4 |
белый кристаллический осадок, растворим в HCl, HNO3 |
окрашивание пламени |
|
Карминово-красный |
|
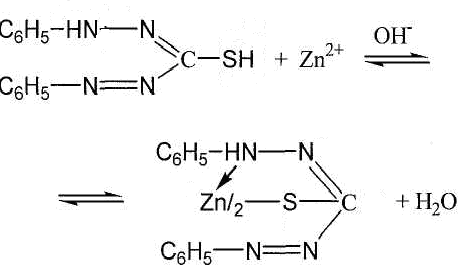
Zn2+ |
NaOH |
Zn2+ + 2OH-→ Zn(OH)2 Zn(OH)2 + 2OH-→ [Zn(OH)4]2- |
выпадение белого осадка с последующим растворением в избытке реактива |
NaOH + дитизон |
|
окрашивание слоя вазелинового масла в красный цвет |
|
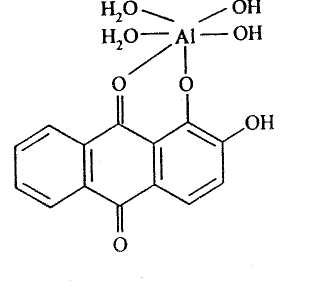
Al3+ |
NaOH |
Al3+ + 3OH-→ Al(OH)3 Al(OH)3 + OH-→ [Al(OH)4]- |
выпадение белого осадка с последующим растворением в избытке реактива |
ализарин |
|
красный осадок |
|
Cr3+ |
NaOH |
Cr3+ + 3OH-→ Cr(OH)3 Cr(OH)3 + OH-→ [Cr(OH)4]- |
выпадение зеленого осадка с последующим растворением в избытке реактива |
NaOH + H2O2 |
2[Cr(OH)4]– + 2OH– + 3H2O2 → 2CrO42– + 8H2O |
желтое окрашивание раствора |
|
Fe2+ |
NaOH |
Fe2+ + 2OH-→ Fe(OH)2
|
желтоватый осадок |
К3[Fe(CN)6] красная кровяная соль |
3Fe2+ + 2[Fe(CN)6]3– → Fe3[Fe(CN)6]2↓
|
турнбулева синь, осадок |
|
Fe3+ |
NaOH |
Fe3+ + 3OH-→ Fe(OH)3
|
рыжий осадок |
К4[Fe(CN)6] желтая кровяная соль |
4Fe3+ + 3[Fe(CN)6]4- → Fe4[Fe(CN)6]3↓
|
берлинская лазурь, осадок |
|
КSCN |
Fe3+ + 4SCN– → [Fe(SCN)4]– |
раствор окрашен в кроваво-красный цвет |
|
Mn2+ |
NaOH |
Mn2+ + 2OH-→ Mn(OH)2 Mn(OH)2 + O2 → MnO2 |
белый осадок, буреющий при стоянии |
NaBiO3 |
2Mn2+ + 5BiO3– + 14H+ → 2MnO4– + 5 Bi3+ + 5Na+ + 7H2O Для проведения берут одну каплю(!) исследуемого раствора, чтобы не протекала реакция диспропорционирования Mn2+ → MnO2↓ ← MnO4–. |
раствор окрашивается в малиновый цвет |
|
Mg2+ |
NaOH |
Mg2+ + 2OH-→ Mg(OH)2 |
|
Na2HPO4 |
Mg2+ + HPO42- + NH4+ → Mg NH4PO4↓ |
белый кристаллический осадок |
|
Bi3+ |
NaOH |
Bi3+ + 3OH-→ Bi(OH)3 |
белый осадок |
разбавление водой |
Bi3+ + Cl– + H2O → BiOCl↓ + 2H+ |
белый осадок |
|
тиомочевина |
Bi3+ + 3(NH2)2CS → [Bi(SC(NH2)2)3]3+ |
желтый комплекс |
|
Cu2+ |
NH4OH |
Cu2+ + 4NH3 → [Cu(NH3)4]2+ |
сине-фиолетовое окрашивание раствора |
Fe |
Cu2+ + Fe → Cu↓ + Fe2+ |
красный осадок металлической меди |
|
окрашивание пламени |
|
Зеленый |
|
Ni2+ |
NH4OH |
Ni2+ + 6NH3 → [Ni(NH3)6]2+ |
синее окрашивание раствора |
диметилглиоксим (реактив Чугаева) |
[Ni(NH3)6]2+ + 2H2Dm → Ni(HDm)2↓ + 2NH4+ + 4NH3
комплекс никеля(II) с диметилглиоксимом |
малиновый осадок |
|
Co2+ |
NH4OH |
Cо2+ + 4NH3 → [Cо(NH3)4]2+ |
сине-розовый раствор |
КSCN |
Co2+
+ 4SCN–
необходимо маскирование железа(ІІІ) |
синее окрашивание раствора |
|
Анионы |
|||
CO32–, HCO3– |
ВaCl2 |
Вa2+ + CO32– → ВaCO3↓ |
белый осадок, растворим в минеральных кислотах |
кислоты |
CO32– + 2H+ → H2CO3 (H2O + CO2↑) |
выделение углекислого газа |
|
известковая вода |
Ca(OH)2 + CO2 → CaCO3↓ + H2O |
помутнение известковой воды |
|
H2PO4–HPO42-, PO43- |
ВaCl2 |
Вa2+ + РO43– → Вa3(РO4)2↓ |
белый осадок, растворим в минеральных кислотах |
модибденовая жидкость |
PO43– + 3NH4+ + 12MoO42– + 24H+ → (NH4)3[PMo12O40]↓ + 12 H2O |
желтый осадок фосфоромолибдата аммония |
|
магнезиальная смесь |
HPO42- + Mg2+ + NH4+ → Mg NH4PO4↓ |
белый кристаллический осадок |
|
SO42– |
ВaCl2 |
SO42– + Ba2+ → BaSO4↓ |
белый кристаллический осадок, не растворим в HCl, HNO3 |
Cl– |
AgNO3, затем NH4OH |
Cl– + Ag+ → AgCl↓ AgCl↓ + 2NH3 → [Ag(NH3)2]+ + Cl– |
белый творожистый осадок, растворимый в аммиаке |
NO3– |
дифениламин |
|
появление синего окрашивания
|
Идентификацию и количественное определение можно также проводить с помощью ион-селективного электрода: Е = Е° – 0,059 lg a(NO3–) |
|||
СН3СОО– |
H2SO4 |
СН3СООNa + H2SO4 → 2CH3COOH + Na2SO4 |
запах уксуса |
FeCl3 |
FeCl3 + 3CH3COONa → → Fe(CH3COO)3 + NaCl 3Fe(CH3COO)3 + 2H2O → →[Fe3(CH3COO)6(OH)2]CH3COO + 2 CH3COOH (при нагревании) |
красно-бурый осадок комплексного соединения |
|
ЛИТЕРАТУРА
1. Пилипенко А.Т., Пятницкий И.В. Аналитическая химия. В 2-х книгах. – М.: Химия, 1990. – Кн. 2. – С. 537-562.
2. Пономарев В.Д. Аналитическая химия. В 2-х частях. – М.: Высшая школа, 1982. – Ч. 1. – С. 149-168, 189-193, 202-206, 224-238, 240-250, 252-271.
3. Харитонов Ю.Я. Аналитическая химия. Аналитика. В 2-х книгах. – М.: Высшая школа, 2001. – Кн. 1. – С. 288-301, 320-592.
4. Алексеев В.Н. Курс качественного химического полумикроанализа. – М.: Химия, 1973. – С.13-32, 121-147, 187-205, 316-371, 409-419, 444-452.
5. Крешков А.П. Основы аналитической химии. Т. 1. – М.: Химия, 1970. – С.145-147, 180-181, 200-201, 246-247, 302-305, 327, 339-341, 342-344, 345-385, 386–428.