
- •Билет 1) 1. Адсорбция на границе твердое тело – газ
- •Теория мономолекулярной адсорбции Ленгмюра
- •Уравнение Фрейндлиха
- •2.Различают два конденсационных метода: физическая конденсация и химическая конденсация.
- •Физическая конденсация
- •Химическая конденсация
- •Теория бэт.
- •2. Мицеллой лиофобной системы называется гетерогенная микросистема, которая состоит из микрокристалла дисперсной фазы, окруженного сольватированными ионами стабилизатора.
- •1. С1 больше с2, и наоборот
- •- Степень дисперсности
- •Билет20)
2. Мицеллой лиофобной системы называется гетерогенная микросистема, которая состоит из микрокристалла дисперсной фазы, окруженного сольватированными ионами стабилизатора.
Возможны два принципиальных разных пути образования ДЭС – диссоциация молекул поверхностного слоя твёрдой фазы и перехода ионов одного знака в раствор и избирательная адсорбция поверхностью твёрдой частицы ионов из дисперсионной среды.
В зависимости от природы коллоидной частицы и электролита и от условий опыта может происходить адсорбция различных ионов. В соответствии с правилом Панета-Фаянса на поверхности твёрдой частицы избирательно адсорбируются только те ионы, которые способны достроить её кристаллическую решётку и изоморфны с ней. Предположим, что твёрдые частицы хлорида серебра диспергированы в водном растворе хлорида калия.
рисуем мицеллы 2 случая
1. С1 больше с2, и наоборот
Биле10) 1.Дисперсными системами называют системы, состоящие из частиц одной фазы, распределенных в другой. Измельчение вещества одной фазы в другой называют диспергированием. Понятие “дисперсный” происходит от латинского “dispersus”- раздробленный. Это может быть твердое вещество, измельченное в жидком или газообразном. Фазу, состоящую из частиц раздробленного вещества, называют дисперсной фазой, а среду, в которой распределены частицы – дисперсионной средой. Любая дисперсная система, независимо от агрегатного состояния вещества, состоит из дисперсной фазы и дисперсионной среды. Одним из характерных признаков дисперсной системы является гетерогенность, которая указывает на наличие межфазной поверхности. Дисперсные системы имеют сильно развитую межфазную поверхность.
Ко второму признаку дисперсных систем относится размер частиц или величина, ему обратная – дисперсность. Чем меньше размер частиц, тем больше дисперсность. Таким образом, для всех дисперсных систем характерны два основных признака: Дисперсность, т.е. высокая раздробленность; Гетерогенность (неоднородность), система состоит из 2-х и более фаз
2. Моющими средствами называют сложные органические соединения, применяемые в чистом виде или с добавками для стирки изделий из текстильных волокон и мытья различных предметов домашнего обихода. Эти средства облегчают также отбеливание и крашение тканей, изготовление эмульсий и суспензий при получении пищевых товаров, красочных составов, очистку и- измельчение руд и других природных материалов, повышают антифрикционную способность смазочных материалов и т.д.
Основной (активной) частью моющих средств являются моющие вещества. Они представляют собой органические соединения, обладающие поверхностной активностью, способностью образовывать пену и полуколлоидный раствор в воде. Благодаря поверхностной активности они понижают поверхностное натяжение воды, увеличивая тем самым ее смачивающую способность.
В молекуле моющих веществ имеется длинная углеводородная цепь R, которая для случая мыла на основе стеариновой кислоты Ci?H35COONa содержит 17 атомов углерода и короткую часть в виде реакционной солеобразующей (карбоксильной) группы.
Полярная часть молекулы обусловливает растворимость мыла в воде, неполярная (гидрофобная) -- затрудняет, тормозит растворение и стремится вытеснить молекулу мыла из моющего раствора на поверхность. В связи с этим мыло в растворе концентрируется главным образом на поверхности моющего раствора. При взбалтывании оно образует пену, которая способствует удалению загрязнений из моющего раствора и характеризует наличие в растворе неизрасходованного моющего вещества.
Адсорбируясь на поверхности моющего раствора, покрывая его, мыло снижает поверхностное натяжение воды, в результате чего вода легче смачивает другие тела, проникает в трещины и т.д. Соотношение длины неполярной и полярной частей в молекуле обусловливает различную растворимость моющего вещества в воде.
С увеличением длины углеводородной цепи понижается растворимость, но повышается твердость моющего вещества. Например, мыло на основе стеариновой кислоты твердое, имеет низкую растворимость в воде комнатной температуры. При добавлении жирных кислот с меньшим количество углеродных атомов улучшается растворимость мыла. Моющие средства содержат Обычно от 8 до 20 углеродных атомов в неполярной части, образуя полуколлоиды, т.е. находятся в растворе как в виде молекул, так и в виде более крупных частиц (агрегатов).
Мыло содержит карбоксильную группу -- СООН, способную взаимодействовать с солями кальция и магния, содержащимися в жесткой воде. Это приводит к образованию нерастворимого «известкового мыла», оседающего на ткани и отрицательно сказывающегося на ее прочности. При производстве других видов моющих веществ карбоксильную группу блокируют или заменяют на иную реакционную полярную группу
Таким образом, свойства моющих веществ зависят от вида и длины углеводородной части и природы активной группы. Углеводородная часть моющих веществ может содержать радикал алифатический
(СНз--GHz--СН2...... СН2 -- сокращенно алкил) или ароматический, например бензольный остаток (арил). Бензол содержит лишь шесть углеродных атомов, поэтому в ароматический цикл вводят несколько углеводородных групп (алкильный остаток). Моющие вещества с таким радикалом называют алкиларильными.
Билет11) 1.ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ- явления, происходящие на поверхности раздела соприкасающихся фаз и характеризующиеся особыми свойствами межфазных поверхностных слоев.
ПОВЕРХНОСТНЫЙ СЛОЙ- неоднородный тонкий слой определенной толщины и объема, который располагается по обе стороны поверхности, разделяющей две соприкасающиеся объемные фазы.
поверхностное натяжение и энергия
пов.нат-работа,кот.необходимо совершить для получения единицы площади поверхности.
пов.энергия-избыточная энергия гетерогенной системы,локализованная в поверхностном слое.
2. Метод диспергирования. Заключается в механическом дроблении твердых тел до заданной дисперсности; диспергирование ультразвуковыми колебаниями; электрическое диспергирование под действием переменного и постоянного тока. Для получения дисперсных систем методом диспергирования широко используют механические аппараты: дробилки, мельницы, ступки, вальцы, краскотерки, встряхиватели. Жидкости распыляются и разбрызгиваются с помощью форсунок, волчков, вращающихся дисков, центрифуг. Диспергирование газов осуществляют главным образом с помощью барботирования их через жидкость. В пенополимерах, пенобетоне, пеногипсе газы получают с помощью веществ, выделяющих газ при повышенной температуре или в химических реакциях. Эффе́кт Ре́биндера — (адсорбционное понижение прочности), изменение механических свойств твёрдых тел вследствие физико-химических процессов, вызывающих уменьшение поверхностной (межфазной) энергии тела. Проявляется в снижении прочности и возникновении хрупкости, уменьшении долговечности, облегчения диспергирования. Для проявления эффекта Ребиндера необходимы следующие условия: Контактирование твердого тела с жидкой средой. Наличие растягивающих напряжений
Билет12)1.Давлением насыщенного пара называется давление пара, находящегося в равновесии со своей жидкостью.Давление насыщенного пара над искривленной поверхностью отличается от давления насыщенного пара над плоской поверхностью. Если поверхность жидкости выпуклая, то давление насыщенного пара над ней выше, чем над плоской. Если поверхность вогнутая, то давление ниже.Количественно давление насыщенного пара над искривленной поверхностью psнп можно вычислить с помощью уравнения Томсона (Кельвина) ps(нп)/p(нп)=exp(+(-) 2 * пов.нат.*Vm/rRT),
где pнп -давление насыщенного пара над плоской поверхностью r-радиус кривизны R-универсальная газовая постоянная Vm-мольный объем жидкости Знак "+" в уравнении (3.1) соответствует выпуклой поверхности, а знак "–" – вогнутой.
2. 1. К осаждению дисперсной фазы - характеризует способность дисперсной системы сохранять равновесное распределение фазы по объему дисперсионной среды или ее устойчивость к разделению фаз. Это свойство называется седиментационная (кинетическая) устойчивость.
2. К агрегации ее частиц. Агрегативная устойчивость - это способность дисперсной системы сохранять неизменной во времени степень дисперсности, т.е. размеры частиц и их индивидуальность. Она обусловлена способностью дисперсных систем образовывать агрегаты (т.е. укрупняться). По отношению к агрегации дисперсные системы могут быть устойчивыми кинетически и термодинамически. Термодинамически устойчивые системы образуются в результате самопроизвольного диспергирования одной из фаз, т.е. самопроизвольного образования гетерогенной свободнодисперсной системы.
Билет13 1.ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ- явления, происходящие на поверхности раздела соприкасающихся фаз и характеризующиеся особыми свойствами межфазных поверхностных слоев.
ПОВЕРХНОСТНЫЙ СЛОЙ- неоднородный тонкий слой определенной толщины и объема, который располагается по обе стороны поверхности, разделяющей две соприкасающиеся объемные фазы. поверхностное натяжение и энергия пов.нат-работа,кот.необходимо совершить для получения единицы площади поверхности. пов.энергия-избыточная энергия гетерогенной системы,локализованная в поверхностном слое.
2. Коагуляцией называется процесс слипания частиц с образованием крупных агрегатов. В результате коагуляции система теряет свою седиментационную устойчивость, так как частицы становятся слишком крупными и не могут участвовать в броуновском движении.
Коагуляция является самопроизвольным процессом, так как она приводит к уменьшению межфазной поверхности и, следовательно, к уменьшению свободной поверхностной энергии.
Правила коагуляции:
1. Все сильные электролиты, добавленные к золю в достаточном количестве, вызывают его коагуляцию. Минимальная концентрация электролита, при которой начинается коагуляция, называется порогом коагуляции Ck. Иногда вместо порога коагуляции используют величину VK, называемую коагулирующей способностью. Это объем золя, который коагулирует под действием 1 моля электролита:
т.е. чем меньше порог коагуляции, тем больше коагулирующая способность электролита.
2. Коагулирующим действием обладает не весь электролит, а только тот ион, заряд которого совпадает по знаку с зарядом противоиона мицеллы лиофобного золя. Этот ион называют ионом–коагулянтом.
3. Коагулирующая способность иона–коагулянта тем больше, чем больше заряд иона.
Билет 14)1.Дисперсные системы- гетерогенные системы,состоящие из 2 и более фаз, у кот.одна из фаз сильно диспергирована в др. фазе пов.явл- явл,кот происходят на границе раздела фаз и приводят к снижению свободной поверх.энергии.
2.По степени раздробленности (дисперсности) системы делятся на следующие классы: грубодисперсные, размер частиц в которых более 10-5 м; тонкодисперсные (микрогетерогенные) с размером частиц от 10-5 до 10-7 м; коллоидно-дисперсные (ультрамикро-гетерогенные) с частицами размером от 10-7 до 10-9м.
Если фиксировать внимание на двух основных компонентах дисперсных систем, то одному из них следует приписать роль дисперсионной среды, а другому - роль дисперсной фазы. В этом случае все дисперсные системы можно классифицировать по агрегатным состояниям фаз.
Эта классификация была предложена Оствальдом и широко используется до настоящего времени. Недостатком классификации следует считать невозможность отнесения дисперсных систем, приготовленных с твердой или жидкой дисперсной фазой, к какому-либо классу,
если размер частиц составляет несколько нанометров. Пример такой классификации приведен в табл. 1.
Академик П.А. Ребиндер предложил более совершенную классификацию дисперсных систем по агрегатным состояниям фаз. Он разделил все дисперсные системы на два класса: свободнодисперсные системы и сплошные (или связнодисперсные) системы (табл. 2 и 3). В свободнодисперсных системах дисперсная фаза не образует сплошных жестких структур (сеток, ферм или каркасов). Эти системы называют золями. В сплошных (связнодисперсных) системах частицы дисперсной фазы образуют жесткие пространственные структуры (сетки, каркасы, фермы). Такие системы оказывают сопротивление деформации сдвига. Их называют гелями.
Дисперсная система по классификации Ребиндера обозначается дробью, в которой дисперсная фаза ставится в числителе, а дисперсионная среда – в знаменателе. Например: Т1/Ж2. Индекс 1 обозначает дисперсную фазу, а индекс 2 – дисперсионную среду.
Билет 15) Электрокинетический потенциал, -потенциал, дзета-потенциал, часть общего скачка потенциала на границе двух фаз, определяющая относительное перемещение этих фаз при электрокинетических явлениях.
ДИСПЕРСНЫЕ СИСТЕМЫ, гетерог. системы из двух или большего числа фаз с сильно развитой пов-стъю раздела между ними.
МИЦЕЛЛООБРАЗОВАНИЕ, самопроизвольная ассоциация молекул ПАВ в р-ре. В результате в системе ПАВ-р-ри-тель возникают м и ц е л л ы-ассоциаты характерного строения, состоящие из десятков дифильных молекул, имеющих длинноцепочечные гидрофобные радикалы и полярные гидрофильные группы. В т.наз. прямых мицеллах ядро образовано гидрофобными радикалами, а гидрофильные группы ориентированы наружу. Число молекул ПАВ, образующих мицеллу, наз. числом агрегации; по аналогии с мол. массой мицеллы характеризуются и т. наз. мицелляр-ной массой. Обычно числа агрегации составляют 50-100, мицеллярные массы равны 103-105. Образующиеся при мицеллообразовании мицеллыполидисперсные и характеризуются распределением по размерам (или числам агрегации).
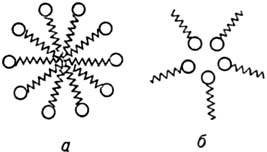
Рис. 2. Схематическое изображение ассоциатов ПАВ в воде: а - сферич. прямая мицелла; б-обращенная мицелла.
При низких концентрациях поверхностно-активные вещества (ПАВ) образуют истинные растворы. При повышении концентрации ПАВ достигается ККМ, т. е. такая концентрация ПАВ, при которой возникают мицеллы, находящиеся в термодинамическом равновесии с неассоциированными молекулами ПАВ. При разбавлении раствора мицеллы распадаются, а при увеличении концентрации ПАВ вновь возникают. Выше ККМ весь избыток ПАВ находится в виде мицелл. При очень большом содержании ПАВ в системе образуются жидкие кристаллы или гели.
Билет16)Со́рбция - поглощение твёрдым телом или жидкостью вещества из окружающей среды. Поглощающее тело называется сорбентом, поглощаемое им вещество — сорбатом (или сорбтивом)
Различают поглощение вещества всей массой жидкого сорбента (абсорбция);поверхностным слоем твёрдого или жидкого сорбента (адсорбция). Поглощение вещества из газовой среды всей массой твёрдого тела или расплава называется также окклюзией. С., сопровождающаяся химическим взаимодействием сорбента с поглощаемым веществом, называется хемосорбцией. При С. паров высокопористыми телами часто имеет место капиллярная конденсация.
Адсорбция (от лат. ad — на, при и sorbeo — поглощаю), поглощение к.-л. вещества из газообразной среды или раствора поверхностным слоем жидкости или твёрдого тела.
(от лат. sedimentum — оседание) - оседание частиц дисперсной фазы (твёрдых крупинок, капелек жидкости, пузырьков газа) в жидкой или газообразной дисперсионной среде в гравитационном поле или поле центробежных сил. Седиментация происходит, если направленное движение частиц под действием силы тяжести или центробежной силы преобладает над хаотическим тепловым движением частиц. Скорость седиментации зависит от массы, размера и формы частиц, вязкости и плотности среды, а также ускорения, возникающего при действии на частицы сил поля
Седиментацио́нный ана́лиз — совокупность методов определения размеров частиц в дисперсных системах и молекулярной массы макромолекул в растворах полимеров по скорости седиментации в условиях седиментационно-диффузного равновесия.
СЕДИМЕНТАЦИОННЫЙ АНАЛИЗ (а. sedimentation analysis; н. Sedimentati- onsanalyse; ф. analyse granulometrique par sedimentation, sedimentometrie; и. analisis sedimentario) — совокупность методов дисперсионного (гранулометрического) анализа, в основе которых лежит зависимость между размером (массой) и скоростью движения тела в вязкой среде (газе или жидкости) под действием гравитационных или центробежных сил. Седиментационный анализ включает наиболее распространённые косвенные методы определения величины частиц, или дисперсности, порошкообразных материалов, аэрозолей, различных грубодисперсных иколлоидных систем. Позволяет определять как усреднённые характеристики дисперсности, так и дисперсный (гранулометрический, зерновой, фракционный) состав анализируемой системы, т.е. долевое распределение массы, объёма, площади поверхности, линейных размеров или числа частиц дисперсной фазы по классам крупности. Основные методы седиментационного анализа — методы установившейся скорости седиментации и седиментационно-диффузионного, или седиментационного равновесия; применяют также методы приближения к седиментационному равновесию. Седиментационный анализ в гравитационном поле применяют для грубодисперсных систем (суспензий, эмульсий, пылей) с размером частиц 10-2-10-4 см. Обычно используют метод установившейся скорости седиментации, причём искомые величины находят по изменению скорости накопления осадка (сливок), плотности столба суспензии (эмульсии), концентрации частиц на определённом уровне и т.д. Приборы для осуществления этого метода, работающие на принципах взвешивания (например, осадка) или измерения гидростатического давления, называется седиментометрами. К седиментационному анализу иногда относят гидроаэродинамические методы дисперсионного анализа измельченного материала, полезных ископаемых, пылей, например, с использованием аппаратов (классификаторов), в которых оседание крупных частиц идёт против восходящего потока газа или жидкости в последовательно соединённых вертикальных цилиндрах с различной площадью сечения, а мелкие частицы выносятся потоком. Седиментационный анализ для высокодисперсных систем с размером частиц менее 10-4 см (которые в обычных условиях седиментационно устойчивы) проводят в поле центробежных сил. Использование центрифуги для седиментирования таких систем было предложено советским учёным А. В. Думанским в 1912. Детальная разработка методов седиментационного анализа в поле центробежных сил проведена изобретателем ультрацентрифуги шведским учёным Т. Сведбергом. Создаваемые в ультрацентрифуге центробежные ускорения в десятки и сотни тысяч раз превосходят ускорение земного тяготения, что обеспечивает седиментацию не только мельчайших коллоидных частиц, но и молекул высокомолекулярных соединений. При седиментационном анализе в ультрацентрифуге характеристикой частиц дисперсной фазы или молекул растворённого полимера может служить константа седиментации — отношение скорости седиментации к ускорению поля центробежных сил. Эта константа зависит от массы и формы частиц (макромолекул). Скорость седиментации или установление седиментационного равновесия в ультрацентрифуге, константы седиментации, массы и размеры коллоидных частиц или макромолекул, а также полидисперсность анализируемой системы вычисляют на основе оптических измерений — по изменению показателей преломления или светопропускания раствора или коллоидной системы. Седиментационный анализ в поле центробежных сил используют для определения молекулярной массы и однородности синтетических и природных полимеров, а также при анализе илистых отложений и коллоидно-дисперсных глинистых минералов. Современные приборы и устройства для седиментационного анализа полностью автоматизированы и компьютеризированы. Результаты анализа, выполненного по заданной программе, после завершения измерений выдаются в виде таблиц, гистограмм, дифференциальных и (или) интегральных кривых распределения, а также усреднённых показателей дисперсности: медианного диаметра, удельной поверхности и др.
Бидет17)
Пове́рхностное натяже́ние — термодинамическая характеристика поверхности раздела двух находящихся в равновесии фаз, определяемая работой обратимого изотермокинетического образования единицы площади этой поверхности раздела при условии, что температура, объём системы и химические потенциалы всех компонентов в обеих фазах остаются постоянными.
Формула Лапласа
Рассмотрим тонкую жидкую плёнку, толщиной которой можно пренебречь. Стремясь минимизировать свою свободную энергию, плёнка создаёт разность давления с разных сторон. Этим объясняется существование мыльных пузырей: плёнка сжимается до тех пор, пока давление внутри пузыря не будет превышать атмосферное на величину добавочного давленияплёнки. Добавочное давление в точке поверхности зависит от средней кривизны в этой точке и даётся формулой Лапласа:
![]() Здесь
Здесь ![]() —
радиусы главных
кривизн в
точке. Они имеют одинаковый знак, если
соответствующие центры кривизны лежат
по одну сторону от касательной
плоскости в
точке, и разный знак — если по разную
сторону. Например, для сферы центры
кривизны в любой точке поверхности
совпадают с центром сферы, поэтому
—
радиусы главных
кривизн в
точке. Они имеют одинаковый знак, если
соответствующие центры кривизны лежат
по одну сторону от касательной
плоскости в
точке, и разный знак — если по разную
сторону. Например, для сферы центры
кривизны в любой точке поверхности
совпадают с центром сферы, поэтому
![]()
![]()
Для
случая поверхности кругового цилиндра
радиуса ![]() имеем
имеем
![]()
![]() Обратите
внимание, что
Обратите
внимание, что ![]() должно
быть непрерывной функцией на поверхности
плёнки, так что выбор «положительной»
стороны плёнки в одной точке локально
однозначно задаёт положительную сторону
поверхности в достаточно близких её
точках. Из формулы Лапласа следует, что
свободная мыльная плёнка, натянутая на
рамку произвольной формы и не образующая
пузырей, будет иметь среднюю кривизну,
равную 0.
должно
быть непрерывной функцией на поверхности
плёнки, так что выбор «положительной»
стороны плёнки в одной точке локально
однозначно задаёт положительную сторону
поверхности в достаточно близких её
точках. Из формулы Лапласа следует, что
свободная мыльная плёнка, натянутая на
рамку произвольной формы и не образующая
пузырей, будет иметь среднюю кривизну,
равную 0.
С увеличением температуры величина поверхностного натяжения уменьшается и равна нулю при критической температуре
