
- •Лекция № 10, 11 по дисциплине «Химическая технология теплоносителя»
- •Литература:
- •1. Необходимость и этапы очистки воды
- •2. Очистка воды методом коагуляции
- •2.1. Сущность и механизм коагуляции
- •2.2. Факторы, влияющие на процесс коагуляции
- •2.3 Флокуляция
- •3. Очистка воды методом осаждения
- •3.1. Известкование воды
- •3.2. Расчет дозы извести для практического использования
- •Минимальная доза извести определяется кол-вом ионов он-, требуемых на реакции (2), (3) и (6).
- •3.3. Содоизвесткование
- •3.4. Обработка едким натром
- •4. Методы осветления воды
- •Принципиальная схема предочистки
Минимальная доза извести определяется кол-вом ионов он-, требуемых на реакции (2), (3) и (6).
![]() (8)
(8)
Тогда:
![]() (9)
(9)
Если
![]() ,
то доза извести, рассчитанная по уравнению
(8) будет достаточна для образования
СаСО3.
Подставив выражения (7) и (9) в это условие,
получим:
,
то доза извести, рассчитанная по уравнению
(8) будет достаточна для образования
СаСО3.
Подставив выражения (7) и (9) в это условие,
получим:
![]()
или
![]() (10)
(10)
При соблюдении условия (10)происходит выделение СаСО3, но не происходит выделения из воды ионов Мg2+.
Если же доза извести будет больше, чем рассчитанная по уравнению (8), то возможно протекание реакции (5) и выделение Мg(ОН)2. Однако, при этом не произойдет дальнейшего снижения жесткости и щелочности, а произойдет лишь замена некарбонатной магниевой жесткости на кальциевую по реакции:
МgСl2 + Са(ОН)2 ↔ Мg(ОН)2 + СаСl2
МgSО4 + Са(ОН)2 ↔ Мg(ОН)2 + СаSО4 (11)
Однако, надо отметить, что свежеосажденный Мg(ОН)2 хорошо сорбирует ионы НsiО3-, что способствует снижению кремнесодержания на 25-30%.
повышается эффективность очистки воды.
Что бы достичь этого эффекта, доза извести должна быть увеличена на величину ЖMg,
![]() (12)
(12)
Тогда:
![]() (13)
(13)
Подставим в условие :
![]()
Ж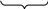 Са
+ ЖMg
+ Дк
Са
+ ЖMg
+ Дк
![]()
Жобщ
Жобщ + Дк (14)
Условие (14) выполняется для большинства природных вод.
Итак, теоретически дозу извести можно определить по уравнениям (8) и (12).
Однако, следует
учитывать, что кроме теоретически
необходимого количества ОН-
ионов, которое требуется для реакций с
СО2,
НСО![]() и Mg2+,
надо вводить избыток извести для смещения
равновесия этих реакций в требуемом
направлении, т.е. вправо.
и Mg2+,
надо вводить избыток извести для смещения
равновесия этих реакций в требуемом
направлении, т.е. вправо.
Обычно эксплуатационный избыток извести составляет 0,1-0,2 мг-экв/кг.
При введении избытка извести в воде появляется гидратная щелочность, рН повышается до 10,1-10,3 единиц, и практически полностью отсутствует бикарбонатная щелочность.
В этом случае расчетная доза извести для практического использования:
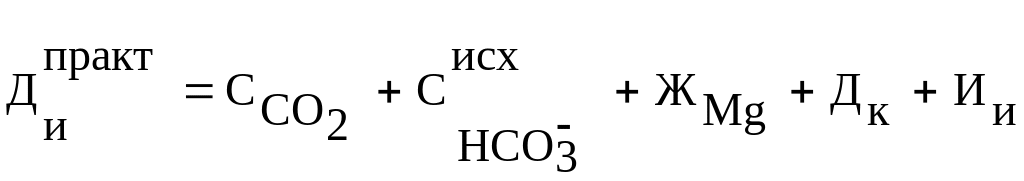 (15)
(15)
3.3. Содоизвесткование
Осуществляется с целью удаления не только карбонатной, но и некарбонатной жесткости. При этом протекают реакции:
Ca(HCO3)2 + Ca(OH)2 2CaCO3 + 2H2O (1)
Mg(HCO3)2 + 2Ca(OH)2 2CaCO3 + Mg(OH)2 + 2H2O (2)
CaSO4 + Na2CO3 CаCO3 + Na2SO4 (3)
MgCl2 + Ca(OH)2 Mg(OH)2 + CаCl2 (4)
CaCl2 + Na2CO3 CaCO3 + 2NaCl (5)
Таким образом, карбонатная жесткость устраняется известью, (1,2) некарбонатная магниевая заменяется на кальциевую известью, (4) некарбонатная кальциевая жесткость устраняется содой (3 и 5).
В настоящее время практически не используется.
3.4. Обработка едким натром
CO2+2NaOHNa2CO3+H2O
Ca(HCO3)2+2NaOHCaCO3+Na2CO3+2H2O
Mg(HCO3)2+4NaOH Mg(OH)2+2Na2CO3+2H2O
CaCl2+Na2CO3CaCO3+2NaCl
MgSO4+2NaOHMg(OH)2+Na2SO4
Применяется крайне редко из-за высокой стоимости NaOH.
Выводы:
1. На АЭС при предварительной очистке воды применяется метод известкования.
2. Содоизвесткование и обработка едким натром в настоящее время широкого применения не находят.
