
- •Лекция № 10, 11 по дисциплине «Химическая технология теплоносителя»
- •Литература:
- •1. Необходимость и этапы очистки воды
- •2. Очистка воды методом коагуляции
- •2.1. Сущность и механизм коагуляции
- •2.2. Факторы, влияющие на процесс коагуляции
- •2.3 Флокуляция
- •3. Очистка воды методом осаждения
- •3.1. Известкование воды
- •3.2. Расчет дозы извести для практического использования
- •Минимальная доза извести определяется кол-вом ионов он-, требуемых на реакции (2), (3) и (6).
- •3.3. Содоизвесткование
- •3.4. Обработка едким натром
- •4. Методы осветления воды
- •Принципиальная схема предочистки
3. Очистка воды методом осаждения
3.1. Известкование воды
Применяется для снижения щелочности (декарбонизации) исходной воды, одновременного уменьшения жесткости, сухого остатка, удаления ГДП, соединений железа. Осуществляется введением в воду гашеной извести Са(ОН)2.
При этом протекают следующие процессы:
диссоциация Са(ОН)2:
(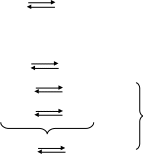 1)
Са(ОН)2 Са2+
+ ОН-
1)
Са(ОН)2 Са2+
+ ОН-
повышение рН
2) гидратация свободной углекислоты с образованием и диссоциацией Н2СО3:
СО2 + Н2О Н2СО3 (гидратация)
Н2СО3 _ + ОН- НСО3- + Н2О
НСО3- + ОН- СО32- + Н2О (диссоциация)
Н2СО3 + 2ОН- СО32- + 2 Н2О
Суммарно эту стадию можно выразить:
( 2)
СО2 + Н2О + 2ОН-
СО32- + 2Н2О
2)
СО2 + Н2О + 2ОН-
СО32- + 2Н2О
(так как на первой стадии рН увеличивается, то равновесие в реакции (2) смещено вправо)
3) диссоциация НСО3- (бикарбонат – ионов, обуславливающих щелочность природной воды):
( 3)
НСО3- + ОН-
СО32- + Н2О
3)
НСО3- + ОН-
СО32- + Н2О
Так как на второй и третьей стадиях вся свободная углекислота и НСО3- - ионы переведены в СО32- - ионы, то в результате достигается величина
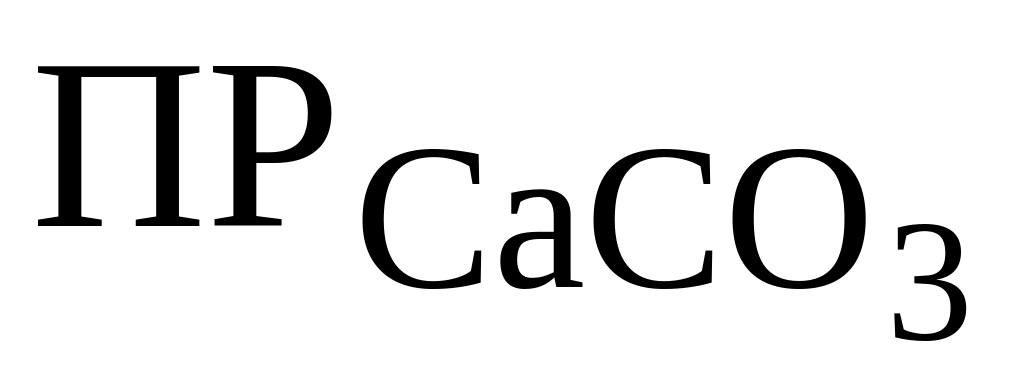 (4,3 · 10-9) и происходит реакция:
(4,3 · 10-9) и происходит реакция:
( 4)
Са2+ + СО32-
СаСО3↓
4)
Са2+ + СО32-
СаСО3↓
Если к воде добавлено
извести больше, чем необходимо для
превращения СО2 и НСО3-
в СО32-, то есть имеется
избыток ОН- - ионов, то возможно
также достижение
![]() (5,5
· 10-12) и образуется малорастворимое
соединение – гидроксид магния:
(5,5
· 10-12) и образуется малорастворимое
соединение – гидроксид магния:
(
 5)
Мg2+ + 2ОН- Мg(ОН)2↓
5)
Мg2+ + 2ОН- Мg(ОН)2↓
При совмещении процессов коагуляции и известкования (а на АЭС при предварительной подготовке воды применяют именно совмещение этих процессов) протекает реакция:
( 6)
4FеSО4
+ О2 + 2Н2О + 8 ОН-
4 Fе(ОН)3 + 4 SО42-
6)
4FеSО4
+ О2 + 2Н2О + 8 ОН-
4 Fе(ОН)3 + 4 SО42-
Как видно из (6), использование солей Fе (II) связано с дополнительным расходом ОН- - ионов, что должно быть учтено при выборе дозы извести.
3.2. Расчет дозы извести для практического использования
Как следует из рассмотренных выше реакций, снижение щелочности происходит в результате образования трудно растворимого СаСО3, для чего эквивалентное количество Са2+, содержащегося в исходной воде и внесенного с известью, должно быть не меньше, чем количество образующихся ионов СО32-.
Ионы СО32- образуются по реакциям (2) и (3), причем по реакциям (3) из одного одновалентного иона НСО3- образуется один двухвалентный ион СО32-. В эквивалентном соотношении получается, что на образование 1 мг-экв/кг ионов СО32- требуется 2 мг-экв/кг ионов НСО3-. В реакции (2) количество образовавшихся ионов СО32- равно (в эквивалентном отношении) количеству свободной углекислоты СО2.
Таким образом, суммарное количество образовавшихся ионов СО32- равно:
![]() ,
(7)
,
(7)
![]() - остаточная
бикарбонатная щелочность известкованной
воды при определенном рН.
- остаточная
бикарбонатная щелочность известкованной
воды при определенном рН.
Ионы Са2+
содержатся в исходной воде (ЖСа),
а также поступают с известью в количестве,
равном количеству ионов ОН- (в
эквивалентном соотношении), то есть
![]()
