
- •Лекция № 10, 11 по дисциплине «Химическая технология теплоносителя»
- •Литература:
- •1. Необходимость и этапы очистки воды
- •2. Очистка воды методом коагуляции
- •2.1. Сущность и механизм коагуляции
- •2.2. Факторы, влияющие на процесс коагуляции
- •2.3 Флокуляция
- •3. Очистка воды методом осаждения
- •3.1. Известкование воды
- •3.2. Расчет дозы извести для практического использования
- •Минимальная доза извести определяется кол-вом ионов он-, требуемых на реакции (2), (3) и (6).
- •3.3. Содоизвесткование
- •3.4. Обработка едким натром
- •4. Методы осветления воды
- •Принципиальная схема предочистки
2. Очистка воды методом коагуляции
2.1. Сущность и механизм коагуляции
Коагуляция – это процесс, при котором происходит понижение степени дисперсности коллоидных примесей в результате агломерации их частиц с образованием макрофазы. (Или: коагуляция – физико-химический процесс укрупнения коллоидных частиц за счет их слипания под действием молекулярных сил притяжения).
Образующаяся при коагуляции твердая макрофаза называется коагулятом, имеет аморфное строение, отличается малой плотностью и механической прочностью.
Процесс коагуляции происходит в результате нарушения агрегативной устойчивости коллоидной системы, которая обусловлена тем, что в данном коллоидном растворе все коллоидные частицы имеют одинаковый по знаку электрический заряд. Так как между частицами с одинаковыми по знаку зарядами действуют силы электростатического отталкивания, взаимного соединения частиц не происходит.
Возникновение электрического заряда коллоидных частиц обусловливается либо адсорбцией ими из раствора ионов одного какого-либо знака заряда, либо отдачей ими в раствор ионов также одного какого-либо знака.
Рассмотрим появление
заряда коллоидных частиц на примере
метакремниевой кислоты Н2SiО3,
являющейся по существу полимером
![]() .
С поверхности частицы, имеющей коллоидные
размеры, в результате гидратации и
диссоциации в раствор переходят ионы
водорода; теряя ионы водорода, твердая
фаза приобретает отрицательный заряд.
.
С поверхности частицы, имеющей коллоидные
размеры, в результате гидратации и
диссоциации в раствор переходят ионы
водорода; теряя ионы водорода, твердая
фаза приобретает отрицательный заряд.
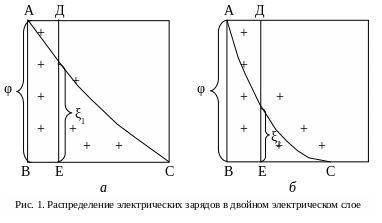
Для твердой фазы коллоидной кремниевой кислоты ионы НSiО3- и SiО32- являются потенциалообразующими, а ионы водорода – противоионами, причем часть противоионов находится непосредственно у поверхности твердой фазы, остальные распределены в некотором объеме жидкости, окружающем коллоидную частицу. Потенциалообразующие частицы и противоионы, находящиеся у поверхности твердой фазы и прочно связанные с ней электростатическими силами, образуют адсорбционный слой (ВЕ). Те ионы, которые перешли в раствор, испытывают на себе действие сил:
силы, стремящейся распределить их по всему объему раствора.
силы электростатического притяжения со стороны твердой фазы.
В результате действия этих сил вокруг коллоидной частицы образуется диффузионный слой ионов, называемый также ионной атмосферой (ЕС). Адсорбционный и диффузионный слои составляют двойной электрический слой (ДЭС) – (ВС).
Между твердой фазой и раствором возникает скачок потенциала (термодинамический потенциал) φ, который уменьшается по мере удаления от поверхности раздела фаз (кривая АС характеризует уменьшение потенциала). При φ = 0 частица является нейтральной.
Из за своих малых размеров коллоидная частица в растворе находится в непрерывном движении (броуновское). В результате трения вместе с твердой фазой перемещается и некоторый слой окружающей ее жидкости толщиной ВЕ. Вместе с этим слоем коллоидная частица по отношению к остальному объему жидкости является отрицательно заряженной. Заряд ее определяется значением потенциала на границе между адсорбционным и диффузионным слоями. Этот потенциал получил название электрокинетического или (дзета) потенциала.
Этот потенциал характеризует агрегативную устойчивость коллоидной системы. Чтобы ее нарушить, необходимо устранить силы отталкивания, действующие между коллоидными частицами и препятствующие их соединению друг с другом, то есть нужно понизить ζ – потенциал.
Способы уменьшения ζ – потенциала:
Добавление к коллоидной системе электролитов.
При этом вокруг твердой фазы повышается концентрация противоположно заряженных ионов (одноименно заряженные твердой фазой отталкиваются). Радиус ионной атмосферы уменьшается, кривая падения полного потенциала проходит круче и пересекает границу между адсорбционным и диффузным слоями при меньших значениях потенциала.
Агрегативная устойчивость системы нарушается, происходит электролитная коагуляция.
Однако в водоподготовке электролитная коагуляция не используется, так как приводит к повышению общего солесодержания воды. Поэтому при очистке воды используют второй способ, основанный на принципе взаимной коагуляции коллоидов.
Взаимная коагуляция коллоидных растворов заключается в том, что к коллоидному раствору, частицы которого имеют, например, отрицательный заряд, добавляют другой коллоидный раствор с положительно заряженными частицами. При этом происходит нейтрализация противоположных зарядов коллоидных частиц, их агломерация и образование твердой фазы.
Так как коллоидно-дисперсные примеси природных вод (кремниевые, гуминовые кислоты, примерная формула С6ОН52О24(СООН)4) характеризуются отрицательным знаком ζ – потенциала, для их коагуляции применяют коллоидные растворы, имеющие положительный ζ – потенциал.
При коагуляции воды положительно заряженный раствор вводят не в готовом виде, а получают непосредственно в обрабатываемой воде.
Реагенты, добавляемые к воде для осуществления коагуляции, называются коагулянтами.
Наибольшее распространение получили Аl2(SО4)3 и FеSО4. При добавлении их в воду происходят следующие процессы:
диссоциация:
А l2(SО4)3
2Аl3+ + 3SО42-
l2(SО4)3
2Аl3+ + 3SО42-
FеSО4 Fе 2+ + SО42-
гидролиз:
Аl3+ + Н2О АlОН2+ + Н+
АlОН2+ + Н2О Аl(ОН)2+ + Н+
А l(ОН)2+
+ Н2О Аl(ОН)3↓ + Н+
l(ОН)2+
+ Н2О Аl(ОН)3↓ + Н+
Fе2+ + Н2О FеОН+ + Н+
FеОН+ + Н2О Fе(ОН)2↓ + Н+
4Fе(ОН)2 + О2 + Н2О 4Fе(ОН)3↓
(при рН > 8)
На промежуточных стадиях гидролиза образуются положительно заряженные коллоидные частицы.
На этой скрытой стадии коагуляции происходит сложный комплекс процессов:
взаимная коагуляция;
электролитная коагуляция под влиянием ионов SО42- и образующихся в первый момент ионов Аl3+;
образование и сцепление микро хлопьев, захват ими ГДП и образование крупных хлопьев.
