
- •Статистическая физика.
- •Максвелловское распределение молекул по скоростям в идеальном газе.
- •Распределение Больцмана.
- •Распределение Гиббса.
- •(Интеграл Пуассона)
- •Уравнение состояния идеального одноатомного газа.
- •Физический смысл свободной энергии.
- •Основное тождество. (уравнение Гиббса - Гельмгольца).
- •Статистический смысл энтропии.
- •Обратимые и необратимые процессы.
- •Цикл Карно.
- •Второй закон термодинамики и следствия из него.
- •Реальные газы.
- •Квантовая статистика.
- •Излучение и поглощение абсолютно черного тела.
- •Теплоемкость твердых тел.
- •Определение среднего значения электронов в электронном газе в Металле при абсолютном нуле
- •Аморфные и кристаллические тела. Теплоемкость кристаллических тел.
- •Электроны в кристаллической решетке.
Второй закон термодинамики и следствия из него.
Рассмотрим
изолированную систему. Тогда в
изолированной системе, находящейся в
равновесном состоянии или в случае
происходящих обратимых процессов
![]() .
.
Рассмотрим случай,
когда в изолированной системе происходит
необратимый процесс
![]() .
Такой процесс будет сопровождаться
ростом энтропии.
.
Такой процесс будет сопровождаться
ростом энтропии.
Покажем, что переход теплоты от горячего тела к холодному происходит в соответствии со вторым законом термодинамики.
Пусть имеются два
тела (первое разогретое, второе холодное),
при этом
![]() .
Установим между ними тепловой контакт.
.
Установим между ними тепловой контакт.
Г ипотетически
возможны 2 случая:
ипотетически
возможны 2 случая:
Некоторое количество теплоты
 переходит от горячего тела к холодному.
переходит от горячего тела к холодному.
![]() (т. к. произошло
понижение количества теплоты первого
тела),
(т. к. произошло
понижение количества теплоты первого
тела),
![]() .
.
Изменение энтропии в целом:
 ;
;

Соотнесем эти выражения со вторым законом термодинамики:
в первом случае
![]() ,
а во втором
,
а во втором
![]() .
.
Следовательно, первый процесс соответствует второму закону термодинамики.
Пусть имеется сосуд с газом. Этот сосуд разделен на две половинки, причем газ изначально находится в одной половинке.

Убираем перегородку, и газ самопроизвольно заполняет весь объем.
Мы предположили, что обмена энергией с окружающей средой не происходит. Поэтому внутренняя энергия не меняется.
Энтропия – это функция состояния, поэтому неважно, каким путем система пришла в новое состояние. Можно предположить, что процесс происходил изотермически.
При изотермическом
расширении газа
![]() .
Тогда:
.
Тогда:
![]()
Воспользуемся
уравнением Менделеева
![]() :
:

![]() .
.
Тогда согласно второму закону термодинамики:
 .
.
Допустим
![]() :
:
![]() .
.
Процесс расширения газа соответствует второму закону термодинамики, энтропия системы при этом возрастает.
Обратный процесс
сопровождался бы уменьшением объема,
который занимает газ. Но тогда
![]() ,
а, следовательно, приращение энтропии
отрицательно, а это противоречит второму
закону термодинамики.
,
а, следовательно, приращение энтропии
отрицательно, а это противоречит второму
закону термодинамики.
Увеличение энтропии в системе сопровождается увеличением хаоса и уменьшением порядка.
Это отражает диаграмма:

Третий закон термодинамики (или теорема Нернста).
Третий закон термодинамики констатирует, что при абсолютном нуле энтропия равна нулю.
При абсолютном нуле движение атомов останавливается (например, в кусочке льда) и система реализуется только лишь через одно состояние.
Согласно теореме Нернста:
![]() ,
а
должна обратиться в ноль.
,
а
должна обратиться в ноль.
![]() .
.
Лекция 9
Теплоемкость идеальных газов.
Теплоемкостью
тела называется
количество теплоты, которое надо сообщить
телу, чтобы изменить его температуру
на
![]() .
.
Существуют понятия удельной теплоемкости (когда нагревается тело массой 1кг) и молярной теплоемкости (когда нагревается вещество в количестве одного моля).
Воспользуемся первым законом термодинамики:
![]()
Согласно введенному определению:
![]()
Различают 2 случая:
1)
![]() .
.
Учитывая
![]() :
:
![]() .
.
Тогда
![]() ,
,
![]() ,
где
,
где
![]() -
число степеней свободы.
-
число степеней свободы.

Если речь идет о молярной теплоемкости:
![]() .
.
2)
![]() .
.
![]() .
.
Воспользуемся
уравнением Менделеева(![]() ):
):

Следовательно,
![]() не зависят от температуры у идеальных
газов.
не зависят от температуры у идеальных
газов.
Для реальных
одноатомных газов это почти так
(например,![]() ).
).
А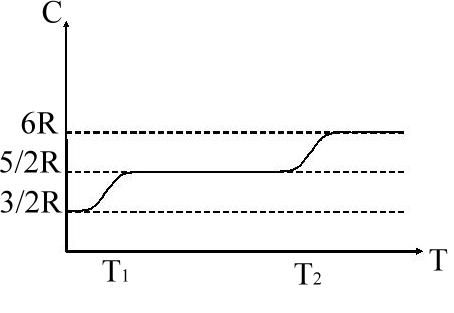 вот для двухатомных газов (например,
вот для двухатомных газов (например,
![]() )
)
в достаточно большом интервале температур газ действительно не зависит от . Однако, при более низких либо достаточно высоких происходит изменения теплоемкости.
Объяснить эти явления в рамках классической физики оказалось невозможным.
Лекция 10
