
- •Статистическая физика.
- •Максвелловское распределение молекул по скоростям в идеальном газе.
- •Распределение Больцмана.
- •Распределение Гиббса.
- •(Интеграл Пуассона)
- •Уравнение состояния идеального одноатомного газа.
- •Физический смысл свободной энергии.
- •Основное тождество. (уравнение Гиббса - Гельмгольца).
- •Статистический смысл энтропии.
- •Обратимые и необратимые процессы.
- •Цикл Карно.
- •Второй закон термодинамики и следствия из него.
- •Реальные газы.
- •Квантовая статистика.
- •Излучение и поглощение абсолютно черного тела.
- •Теплоемкость твердых тел.
- •Определение среднего значения электронов в электронном газе в Металле при абсолютном нуле
- •Аморфные и кристаллические тела. Теплоемкость кристаллических тел.
- •Электроны в кристаллической решетке.
(Интеграл Пуассона)

![]()
(1) - выражение
для свободной энергии идеального
одноатомного газа.
- выражение
для свободной энергии идеального
одноатомного газа.
Уравнение состояния идеального одноатомного газа.
Энергия газа в самом общем случае складывается из кинетической энергии молекул, потенциальной за счет взаимодействия с внешним полем и потенциальной энергии при взаимодействии молекулы со стенками сосуда (кинетическая энергия переходит в потенциальную энергию молекулы и стенки).
![]()
Выделим направление
вдоль оси
![]() ,
возьмем производную по
,
возьмем производную по
![]() :
:
![]()
При изучении
механики было показано
![]() .
.
![]() ,
где
- полная энергия.
,
где
- полная энергия.
![]() .
.
- площадь грани сосуда, перпендикулярный оси .
![]() .
.
Воспользуемся интегралом по Г – пространству.
![]() .
.
Возьмем производную
по
![]() .
.

![]()
![]()
![]() - уравнение
состояния.
- уравнение
состояния.
В общем случае уравнением состояния называется уравнение, которое связывает три макроскопических состояния.
Найдем выражение для давления идеального газа с учетом формулы для .

![]() - закон Менделеева.
- закон Менделеева.
Лекция 6
Физический смысл свободной энергии.
Проанализируем
выражение для
.
Если
постоянно, то свободная энергия зависит
от
![]() и
.
Из формулы (1) следует, что значения
энергии зависят только от
и
.
Можно выполнять разные процессы, переводя
газ из одного состояния в другое. Но
если мы вернемся в начальное состояние,
то и значение энергии будет тем же самым.
и
.
Из формулы (1) следует, что значения
энергии зависят только от
и
.
Можно выполнять разные процессы, переводя
газ из одного состояния в другое. Но
если мы вернемся в начальное состояние,
то и значение энергии будет тем же самым.
Такие функции называют функциями состояния.
![]() .
.
Воспользуемся
![]() .
.
Тогда
![]() ,
,
![]() .
.
Рассмотрим изотермический процесс:
![]() .
.
Только в изотермическом
процессе
![]() - элемент работы:
- элемент работы:
![]() .
.
Т.о. в изотермическом процессе изменение свободной энергии равно работе системы с противоположным знаком.
Основное тождество. (уравнение Гиббса - Гельмгольца).
Будем исходить из
![]() :
:
Возьмем производную по температуре:

![]()
![]()

![]() - внутренняя
энергия.
- внутренняя
энергия.
![]() .
.
Мы рассматриваем равновесное состояние газа, при котором макроскопические параметры не меняются, сколько бы раз ни повторяли измерения.
Экспериментальные результаты для равновесного состояния совпадают с их средними значениями. На этом основании значки средних значений можно убрать.
![]() .
.
![]() - основное
тождество.
- основное
тождество.
Лекция 7
![]() - энтропия.
- энтропия.
![]() -
другая формулировка основного тождества.
-
другая формулировка основного тождества.
Пока будем рассматривать как функцию состояния, физический смысл которой будет выяснен дальше.
Запишем выражение для дифференциала внутренней энергии:
 .
.
![]()
![]()
Из первого закона
термодинамики
![]()
![]() - термодинамический
смысл энтропии
– это такая функция состояния, бесконечно
малое изменение которой равняется
отношению бесконечно малого количества
теплоты, сообщаемого системе к температуре,
при которой это происходит.
- термодинамический
смысл энтропии
– это такая функция состояния, бесконечно
малое изменение которой равняется
отношению бесконечно малого количества
теплоты, сообщаемого системе к температуре,
при которой это происходит.
Предполагается, что температура системы остается величиной постоянной
Статистический смысл энтропии.
Из уравнения Гиббса – Гельмгольца:
![]()
 .
.
Обозначим
![]() ;
;
![]() ,
и, т. к. функция распределения
,
и, т. к. функция распределения
![]() ,
используем выражение для среднего:
,
используем выражение для среднего:
![]() .
.
Записанное выражение отражает статистический смысл энтропии. Энтропия прямо пропорциональна среднему значению логарифма функции распределения.
Анализируя статистический смысл энтропии, рассмотрим следующий пример.
Допустим, есть два
объема:
![]() ,
причем в объемах содержится одинаковое
количество молекул
.
,
причем в объемах содержится одинаковое
количество молекул
.
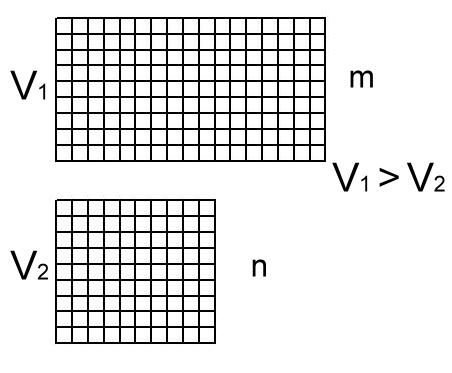
Введем достаточно
маленький объемчик
![]() и разобьем
и разобьем
![]() и
и
![]() на такие элементарные объемы.
на такие элементарные объемы.
В первом случае
получим
![]() -ячеек,
во втором
-ячеек.
Одну молекулу можно распределить
-способами
в
и
-способами
в
.
-ячеек,
во втором
-ячеек.
Одну молекулу можно распределить
-способами
в
и
-способами
в
.
Тогда в первом
случае:
![]() ,
во втором:
,
во втором:
![]() .
.
Найдем отношение
![]() .
.
![]() ,
,
(2)![]() .
.
.
Рассмотрим переход газа при изотермическом процессе от до :
![]() (первый закон
термодинамики).
(первый закон
термодинамики).
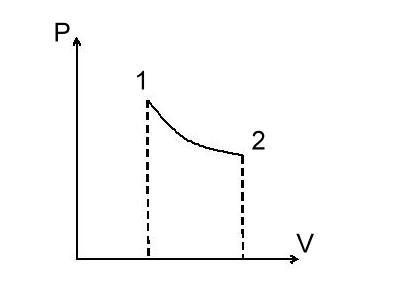
В изотермическом
процессе
![]() ,
,
![]() ,
,
Из уравнения
Менделеева:
![]() ,
,
![]() ,
,
 ,
,
![]() .
.
Чтобы было соответствие с рисунком, переобозначим точки:
(3)![]() .
.
Сравним (2) и (3).
Домножим обе части
(2) на
![]() :
:
![]()
![]()
![]()
Энтропия пропорциональна числу возможных способов размещения в объеме.
Число возможных различных состояний будем называть термодинамической вероятностью.
Лекция 8
