
- •Общие сведения
- •Общие сведения
- •Глава 5. Железо и его сплавы
- •Общие сведения
- •1.2. Углеродистые стали
- •Общие сведения
- •Глава 13, Цветные металлы и сплавы
- •Общие сведения
- •Глава 14. Порошковые материалы
- •Общие сведения
- •Глава 15. Металлы и сплавы для работы при низких температурах
- •Общие сведения
- •Общие сведения
- •Общие сведения
- •Общие сведения
- •Общие сведения
- •Раздел I производство черных и цветных металлов.
- •Глава 1
- •1. Исходные материалы для доменного производства
- •2. Доменная печь
- •3. Доменный процесс
- •4 . Производство литейного чугуна
- •Глава 2
- •1. Кислородно-конвертерное произсодство стали
- •М артеновское производство стали
- •3. Производство стали в электропечах
- •4. Рафинирование стали в установках для переплава
- •5. Разливка стали
- •6. Внепечные способы рафинирования стали
- •Глава 3
- •1. Производство меди
- •2. Производство алюминия
- •3. Производство магния
- •4. Производство титана
- •Раздел II металловедение
- •Глава 1
- •1. Общие сведения
- •2. Кристаллическое строение металлов
- •3. Дефекты строения кристаллических тел
- •3.1. Точечные дефекты
- •3.2. Линейные дефекты
- •3.3. Теоретическая и фактическая прочность
- •3.4. Поверхностные дефекты
- •4. Кристаллизация металлов
- •4.1. Энергетические условия кристаллизации
- •4.2. Механизм процесса кристаллизации
- •4.3. Строение слитка спокойной стали
- •Глава 2
- •1. Свойства металлов и сплавов
- •2. Упругая и пластическая деформация
- •3. Хрупкое и вязкое разрушение
- •4. Факторы, определяющие характер разрушения
- •5. Наклеп, возврат и рекристаллизация
- •Глава 3
- •1. Общие сведения
- •2. Особенности испытаний при низких температурах
- •3. Статические испытания
- •4. Динамические испытания
- •5. Испытания долговечности металлов
- •5.1. Усталостные испытания
- •5.2. Испытания на ползучесть
- •6. Трещнностойкость металлов и коэффициент интенсивности напряжений
- •7. Испытания на вязкость разрушения
- •Глава 4
- •1. Общие сведения
- •2. Основные типы диаграмм состояния
- •2.1. Диаграмма состояния сплавов, образующих механические смеси из чистых компонентов
- •2.2. Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии
- •2.3. Правило отрезков
- •2.4. Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии
- •2.5. Диаграмма состояния сплавов с перитектическим превращением
- •2.6. Диаграмма состояния сплавов, образующих химические соединения
- •2.7. Диаграмма состояния сплавов, испытывающих полиморфные превращения
- •3. Связь диаграмм состояния со свойствами сплавов
- •4. Основные сведения о диаграммах состояния тройных систем
- •Глава 5
- •1. Компоненты и фазы в сплавах железа с углеродом
- •2 Диаграмма состояния железо-цементит
- •3. Диаграмма состояния железо-графит
- •4. Углеродистые стали
- •4.1. Влияние углерода на свойства стали
- •4.2. Влияние примесей на свойства стали
- •4.3. Классификация углеродистых сталей
- •4.4. Стали обыкновенного качества
- •4.5. Качественные углеродистые стали
- •5. Чугуны
- •5.1. Виды чугунов
- •5.2. Факторы, способствующие графитизации
- •5 .3. Микроструктура и свойства чугуна
- •1. Общие сведения
- •2. Виды термической обработки стали
- •3. Превращения в стали при нагреве. Образование аустенита
- •4. Превращение аустенита в перлит при охлаждении. Диаграмма изотермического превращения аустенита
- •5. Мартееситное превращение аустенита
- •6 . Превращения при отпуске закаленной стали
- •Глава 7
- •1. Отжиг и нормализация
- •2. Закалка стали
- •3. Отпуск закаленной стали
- •4. Термомеханическая обработка (тмо) стали
- •Глава 8
- •1. Упрочнение поверхности методом пластического деформирования
- •2. Поверхностная закалка
- •3. Химико-термическая обработка стали
- •3.1. Общие сведения
- •3.2. Цементация стали
- •3.3. Азотирование стали
- •3.4. Цианирование стали
- •3.5 Диффузионная металлизация
- •Глава 9
- •1 Влияние легирующих элементов
- •1.1. Влияние легирующих элементов на свойства феррита
- •1.2. Карбиды в легированных сталях
- •1.3. Влияние легирующих элементов на превращения в стали
- •1.4. Особенности закалки и отпуска легированных сталей
- •2. Классификация легированных сталей
- •3. Маркировка легированных сталей
- •Глава 10
- •1. Характеристика конструкционных сталей
- •2. Стали для строительных конструкций
- •3. Цементуемые стали
- •4. Улучшаемые стали
- •5. Высокопрочные стали
- •6. Рессорно-пружинные стали
- •7. Подшипниковые стали
- •8. Износостойкая аустенитная высокомарганцевая сталь
- •Глава 11 инструментальные стали
- •1. Стали для режущего инструмента
- •1.1. Требования к сталям
- •1.2. Углеродистые стали
- •1.3. Легированные стали
- •1.4. Быстрорежущие стали
- •2. Металлокерамические твердые сплавы
- •3. Стали для измерительного инструмента
- •4. Штамповые стали
- •4.1. Стали для штампов холодного деформирования
- •4.2. Стали для штампов горячего деформирования
- •Глава 12
- •1. Коррозионностойкие стали
- •1.1. Общие сведения
- •1.2. Хромистые стали
- •1.4. Другие методы защиты От коррозии
- •2. Жаростойкие и жаропрочные стали и сплавы
- •3. Стали и сплавы с особыми физическими свойствами
- •3.1. Магнитные стали и сплавы
- •3.2. Электротехнические стали и сплавы
- •3.3. Сплавы с малым температурным коэффициентом линейного расширения
- •3.4. Сплавы для упругих элементов
- •3.5. Сплавы с эффектом памяти формы
- •Глава 13
- •1. Титан и его сплавы
- •2. Алюминий и его сплавы 2.1. Применение и основные свойства
- •2.2. Классификация алюминиевых сплавов
- •2.3. Деформируемые алюминиевые сплавы
- •2.4. Литейные алюминиевые сплавы
- •3.2. Строение композиционных материалов
- •3.3. Дисперсноупрочненные композиционные материалы на основе алюминия
- •3.4. Армированные композиционные материалы на основе алюминия и его сплавов
- •4. Магний и его сплавы
- •5. Медь и ее сплавы
- •5.1. Основные свойства меди
- •5.2. Сплавы меди с цинком или латуни
- •5.3. Бронзы
- •6. Антифрикционные сплавы
- •7. Припои
- •Глава 14
- •1. Общие сведения
- •2. Конструкционные материалы
- •3. Антифрикционные материалы
- •4. Фрикционные материалы
- •5. Пористые фильтрующие элементы
- •Глава 15
- •1. Общие сведения
- •2. Свойства и применение сталей при низких температурах
- •2.1. Влияние легирующих элементов на хладостойкость сталей климатического холода
- •2.2. Ферритные низкоуглеродистые никелевые стали
- •2.3. Аустенитные стали
- •2.4. Железоникелевые сплавы
- •3. Свойства и применение алюминиевых сплавов при низких температурах
- •4. Свойства и применение сплавов титана при низких температурах
- •5. Свойства и применение сплавов меди при низких температурах
- •6. Выбор конструкционных материалов для работы при низких температурах
- •6.1. Механические свойства
- •6.2. Совместимость с рабочей средой
- •6.3. Физические свойства
- •6.4. Технологические свойства
- •Раздел III. Литейное производство
- •Глава 1
- •1. Общие понятия
- •2. Формовочные материалы
- •3. Оснастка
- •4. Ручная формовка
- •5. Машинная формовка
- •6. Изготовление стержней
- •7. Окраска и сборка форм
- •8. Заливка и другие окончательные операции
- •Глава 2
- •1. Литье в кокиль
- •2. Литье по выплавляемым моделям
- •3. Центробежное литье
- •4. Литье под давлением
- •5. Литье в оболочковые формы
- •6. Другие специальные способы литья
- •Глава 3
- •1. Классификация дефектов
- •2. Выбор вида технологического процесса
- •3. Анализ технологичности
- •Глава 1
- •Глава 2
- •1. Способы прокатки
- •2. Классификация прокатных станов
- •3. Основы технологии продольной прокатки
- •5 . Специальные виды прокатки
- •6. Производство гнутых профилей
- •7. Производство сварных труб
- •Глава 3
- •1. Основные понятия и закономерности процесса волочения
- •2. Производство проволоки
- •3. Производство прутков и профилей
- •4. Производство труб
- •Глава 4
- •1. Прессовое оборудование
- •2. Технология прессования
- •3. Гидроэкструзия
- •Глава 5
- •1. Технология ковки
- •Глава 6
- •1. Горячая объемная штамповка
- •2. Холодная объемная штамповка
- •3. Листовая штамповка
- •Глава 7
- •1. Эффект сверхпластичности и его использование в процессах омд
- •2. Высокоскоростные и импульсные методы обработки металлов давлением
- •Раздел V. Сварочное производство
- •Глава 1
- •1. Роль и место технологического процесса сварки в современном производстве
- •2. Физическая сущность процесса сварки. Классификация
- •3. Сущность основных способов сварки плавлением и область их рационального применения
- •4. Сущность основных способов сварки давлением
- •Глава 2
- •1 . Сварочные материалы
- •2. Тепловое воздействие сварочного источника на свариваемый металл.
- •3. Деформация и напряжения, возникающие при сварке, и способы борьбы с ними
- •4. Источники питания для сварки
- •5. Автоматическое регулирование процессов дуговой сварки
- •Глава 3
- •1. Пайка металлов
- •2. Газокислородная резка металлов
- •Раздел VI. Обработка резанием
- •Глава 1
- •1. Схемы обработки и классификация движений в процессе резания
- •2. Элементы токарного проходного резца
- •3. Элементы резания и параметры срезаемого слоя
- •4. Процесс резания и образования стружки
- •5. Наростообразование при резании металлов
- •6. Силы резания и мощность при точении
- •7. Тепловые явления при резании
- •8. Применение смазочно-охлаждающих жидкостей
- •9. Износ и стойкость режущих инструментов
- •10. Упрочнение при обработке резанием
- •11. Производительность и выбор режима резания
- •12. Материалы для изготовления режущих инструментов
- •13. Обрабатываемость материалов
- •Глава 2
- •1. Классификация и обозначение металлорежущих станков
- •2. Приводы и передачи металлорежущих станков
- •3. Элементарные механизмы станков
- •4. Настройка кинематических цепей станков
- •Глава 3
- •1. Общие сведения
- •2. Классификация и типы токарных резцов
- •6. Обработка заготовок на токарно-револьверных станках
- •7. Токарно-карусельные и лобовые станки
- •8. Обработка заготовок на токарных автоматах и полуавтоматах
- •Глава 4
- •1. Сверление отверстий
- •2. Элементы и силы резания при сверлении
- •5. Сверлильные станки
- •Глава 5
- •1. Сущность фрезерования и классификация фрез
- •2. Элементы резания при фрезеровании
- •3. Силы и мощность резания при фрезеровании
- •4. Обработка заготовок на консольно-фрезерных станках
- •7. Приспособления для закрепления фрез
- •Глава 6
- •I. Особенности обработки строганием и долблением
- •2. Строгальные и долбежные резцы
- •3. Строгальные станки
- •4. Обработка заюговок на долбежных и протяжных станках
- •5. Протяжные станки
- •Глава 7 зубонарезание
- •1. Общие сведения
- •2. Нарезание зубчатых колес методом копирования
- •3. Нарезание зубчатых колес методом обкатки
- •4. Изготовление зубчатых колес на зубофрезерных станках
- •5. Изготовление зубчатых колес на зубодолбежных и зубострогальных станках
- •Глава 8
- •1. Общие сведения
- •4. Отделочные методы абразивной обработки
- •Глава 9
- •1. Общие сведения
- •2. Станки с программным управлением
- •4. Автоматические поточные линии и гибкие автоматические производства
- •Глава 10
- •1. Сущность методов обработки пластическим деформированием
- •3. Упрочняюще-калибрующие методы
- •Глава 11
2. Производство алюминия
В группу легких металлов, имеющих плотность меньше 5 г/см3,входят Al, Mg, Ti, Be, Ca, В, Zn, К и другие элементы. Наибольшее промышленное применение из них имеют алюминий, магний,титан.
Алюминий является самым распространенным металлом в земной коре. Он преимущественно встречается в виде соединений с кислородом и кремнием - алюмосиликатов. Для получения алюминия используют руды, богатые глиноземом А12О3. Чаще всего применяют бокситы, в которых содержится, %: А12О3 40— 60, Fe2O3 15—30, SiO2 5—15, TiO2 2—4 и гидратной влаги 10—15.
Технологический процесс производства алюминия состоит из трех этапов: извлечение глинозема из алюминиевых руд, электролиз расплавленного глинозема с получением первичного алюминия и его рафинирование. Извлечение глинозема обычно производят щелочным способом, применяемым в двух вариантах: мокром (метод Байера) и сухом.
При мокром методе бокситы сушат, измельчают и загружают в герметические автоклавы с концентрированной щелочью, где выдерживают в течение 2 — 3 ч при температуре 150 — 250 °С и давлении до 3 МПа. При этом протекают реакции взаимодействия гидрооксида алюминия с едким натром:
А12О8+3Н2О + 2NaOH = Na2O·A12O3 + 4Н2О.
Раствор алюмината натрия Na2O.Al2O в виде горячей пульпы идет на дальнейшую переработку. Оксиды железа, титана и другие примеси, нерастворяющиеся в щелочах, выпадают в осадок — шлам.
Кремнезем взаимодействует со щелочью и образует силикат натрия: SiO2 + 2NaOH == Na2O·SiO2 + 4Н2О, который в свою очередь, взаимодействуя с алюминатом натрия, выпадает в осадок, образуя нерастворимое соединение Na2O·Al2O3·2SiO2·2H2O.
Пульпа после фильтрации и разбавления водой сливается в отстойники, где из алюминатного раствора выпадает в осадок гидрооксид алюминия: Na2O·AlO3 + 4Н2О = 2NaOH + 2А1(ОН)3 ↓.
Гидроксид алюминия фильтруют и прокаливают при температуре до 1200 °С в трубчатых вращающихся печах. В результате получается глинозем: 2А1(ОН)3=А12О3 + 3Н2О.
Сухой щелочной способ или способ спекания состоит в совместном прокаливании при температурах 1200 — 1300 °С смеси боксита, соды и извести, приводящем к образованию спека, в котором содержится водорастворимый алюминат натрия:
А12О3 + Na2CO3 = Na2O·Al2O3 + СО2.
Известь расходуется на образование нерастворимого в воде силиката кальция CaO·SiO2. Алюминат натрия выщелачивают из спека горячей водой и полученный раствор продувают углекислотой:
Na2O·Al2O3 + ЗН2О + СО2 = 2А1(ОН)3 + Na2CO3.
Осадок промывают и прокаливают, получая глинозем, как и в предыдущем способе.
Алюминий получают электролизом глинозема, растворенного в расплавленном криолите Na3AlF6. Этот метод был предложен в 1886 г. одновременно Ч. Холлом в США и П. Эру во Франции и применяется до сих пор почти без изменений. Криолит получают в результате взаимодействия плавиковой кислоты HF с гидрооксидом алюминия с последующей нейтрализацией содой:
6HF + А1(ОН)3 = H3AlF6 + 3H2O,
H3AlFe + 3Na2C03 = 2Na3AlF6 + ЗН2О + СО2,
Э
Рис. 16. Схема
электролизера для производства алюминия:
1
- катодные угольные блоки;2 - огнеупорная
футеровка; 3
- стальной кожух; 4
- угольные
плиты; 5
- жидкий
алюминий; 6
- металлическиестержни
с шинами;7 - угольный анод; 8
-
глинозем; 9жидкий
электролит;10
-
корка затвердевшего электролита;11
-
катодная токоподводящаяшина; 12
- фундамент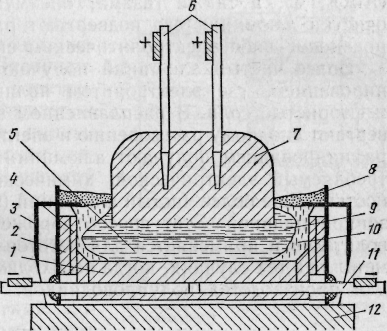 лектролиз
осуществляют в алюминиевой ванне —
электролизере, схема которого
приведена на рис. 16. Ванна имеет стальной
кожух прямоугольной формы, а ее стену
и подину изготавливают из угольных
блоков, теплоизолированных шамотным
кирпичем. В футеровку подины вмонтированы
лектролиз
осуществляют в алюминиевой ванне —
электролизере, схема которого
приведена на рис. 16. Ванна имеет стальной
кожух прямоугольной формы, а ее стену
и подину изготавливают из угольных
блоков, теплоизолированных шамотным
кирпичем. В футеровку подины вмонтированы
При высокой температуре глинозем А12О3 растворенный в электролите, диссоциирует на ионы: А12О3 2А13+ + 3О2-. На поверхности угольной подины, являющейся катодом, ионы восстанавливаются до металла: 2А13+ + 6е = 2А1.
По мере уменьшения содержания глинозема в электролите его периодически загружают в ванну электролизера. Жидкий алюминий скапливается на подине электролизера и периодически удаляется с помощью вакуумных ковшей.
Кислородные ионы разряжаются на угольном аноде: 3О2- - 6е =3/2O2, окисляют анод, образуя СО и СО2, которые удаляются вентиляционными устройствами. Электролизные ванны соединяют последовательно в серии из 100—200 ванн.
Первичный алюминий, полученный в электролизной ванне, загрязнен примесями Si, Fe, неметаллическими включениями (А12О3, С), а также газами, преимущественно водородом. Для очистки алюминия его подвергают рафинированию либо хлорированием, либо электролитическим способом,
Более чистый алюминий получают электролитическим рафинированием, где электролитом являются безводные хлористые и фтористые соли. В расплавленном электролите алюминий подвергают анодному растворению и электролизу. Электролитическим рафинированием получают алюминий чистотой до 99,996 %, потребляемый электрической, химической и пищевой промышленностью. Еще более чистый алюминий (99,9999 %) можно получить зонной плавкой. Этот способ дороже электролиза, мало производителен и применяется для изготовления небольших количеств металла в тех случаях, когда необходима особая чистота, например для производства полупроводников.
