
- •Поняття ісе. Хімічний сенсор. Будова типового хімічного сенсора.
- •Принцип роботи іСе. Електрохімічна комірка. Поняття про гальванічний елемент. Рівняння Нікольського-Ейзенмана.
- •Класифікація ісе за природою та агрегатним станом.
- •Основні характеристики ісе. Селективність. Межа визначення.
- •Основні характеристики ісе. Калібрувальна характеристика ісе (лінійність електродної функції). Час відгуку.
- •Загальна характеристика сенсорів зі скляними мембранами.
- •Загальна характеристика сенсорів із твердими мембранами.
- •Загальна характеристика сенсорів із полімерними мембранами.
- •Загальна характеристика сенсорів з рідкими мембранами.
Поняття ісе. Хімічний сенсор. Будова типового хімічного сенсора.
За визначенням ІЮПАК іон селективні електроди - цс хімічні сенсори (чутливі елементи, датчики), потенціал яких лінійно залежить від логарифму активності іона, який визначають в розчині.
Хімічний сенсор - цс пристрій, який вибірково реагує на конкретний об’єкт шляхом хімічної реакції і який можна використати для якісного або кількісного визначення досліджуваного компонента.
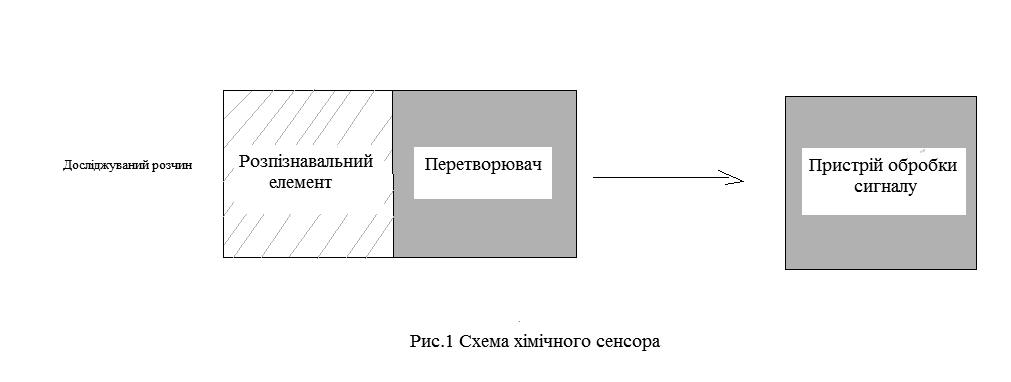
Хімічний сенсор можна використовувати для визначення як одного компонента так і цілої групи. Будь-який хімічний сенсор складається із двох основних частин: блоку, де відбувається хімічна реакція і перетворювача (трансд’юсера). Результатом хімічної реакції є сигнал - зміна електричного потенціалу, оптичної густини, теплоти, кольору тощо. Перетворювач відгукується на цей сигнал і перетворює його в дані про кількість досліджуваної речовини(рис.1). Найбільш поширеними сенсорами є сенсори на основі ІСЕ.
Принцип роботи іСе. Електрохімічна комірка. Поняття про гальванічний елемент. Рівняння Нікольського-Ейзенмана.
ІСЕ працюють за принципом концентраційної комірки (рис. 2). У цих електродах існує селективна мембрана, завдяки якій виникає потенціал у випадку різниці концентрації іона по різні сторони мембрани.
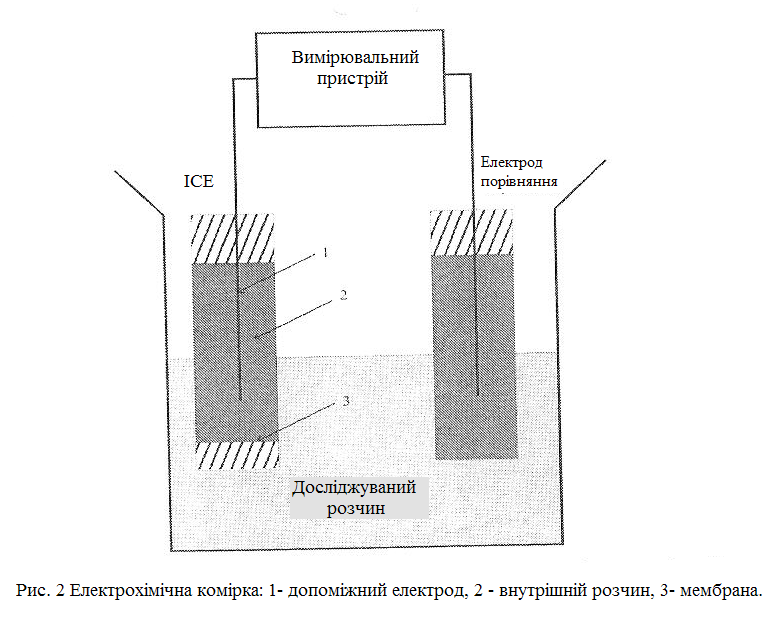
Мембрану називають чутливим елементом ІСЕ, а внутрішній розчин з допоміжним електродом - струмовідводом. Завдання цих елементів полягає в забезпеченні переходу від іонної провідностгі мембрани до електронної провідності металічних проводів.
Під час занурення ІСЕ в розчин мембрана відділяє внутрішній розчин від досліджуваного зовнішнього розчину. Між фазою мембрани й обома розчинами починається процес обміну іонами, які рухають в сторону фази із меншою рухливістю іонів даного виду. Мембрана не пропускає частину іонів і тому на межі розділу фаз виникають скачки електричного потенціалу, які перешкоджають подальшому обміну іонів між фазами. За деякий час встановлюється рівновага заряджених частинок між розчинами і мембраною.
Гальванічний елемент з ІСЕ можна описати наступною схемою:
Електрод порівняння (зовнішній) |
Досліджуваний розчин а1 |
Мембрана |
Внутрішній розчин а2 |
Електрод порівняння (внутрішній) |
Потенціал системи, яка складається їз зовнішнього електрода й ІСЕ, занурених у розчин, описують рівнянням Нікольського-Ейзенмана:

Де
![]() -
яка залежитьб від значень стандартних
потенціалів зовнішнього та внутрішнього
електродів порівняння і від природи
мембрани ІСЕ; ai,
zi
та aj,
zj
– активності та заряди основного
(потенціалвизначального) та стороннього
електроду відповідно;
-
яка залежитьб від значень стандартних
потенціалів зовнішнього та внутрішнього
електродів порівняння і від природи
мембрани ІСЕ; ai,
zi
та aj,
zj
– активності та заряди основного
(потенціалвизначального) та стороннього
електроду відповідно;
![]() - Коефійієнт селективності ІСЕ відносно
потенціал визначального іона і присутності
стороннього.
- Коефійієнт селективності ІСЕ відносно
потенціал визначального іона і присутності
стороннього.
Класифікація ісе за природою та агрегатним станом.
Класифікація ІСЕ базується на відмінностях хімічних селективних реакції, які приводять до виникнення міжфазного потенціалу.
Зачежно від природи мембрани розрізняють наступні типи мебранних іон селективних елекіродів:
Пер винні І СЕ:
електроди зі скляною мембраною;
кристалічні (твердофазні) мембранні електроди;
електроди з рідкою мембраною
рідкі іоннообмінні мембранні електроди;
електроди з рідкою мембраною та нейтральними носіями.
Складні або багатомембранні електроди:
газочутливі;
ферментні.
Іонсслективні польові транзистори (ІСПТ).
Розрізняють інші способи класифікації:
Тверді електроди (гомогенні, гетерогенні на основі іонообмінних смол, стекол моно- та полікристалів);
Рідинні електроди на основі рідких іонітів, хелатів, біологічно активних речовин;
Плівкові (матричні) електроди на тій самій основі, що й рідинні, активних речовин, полімерної матриці і пластифікатора;
Газові та ферментні електроди.
