
- •1. Общая схема синтеза и распада пиримидиновых нуклеотидов. Регуляция. Оротацидурия.
- •2. Общая схема синтеза и распада пуриновых нуклеотидов. Регуляция. Подагра.
- •3. Синтез дезоксирибонуклеотидов. Регуляция.
- •4. Общая схема распада нуклеиновых кислот, ферменты, субстраты, продукты.
- •7. Первичная структура нуклеиновых кислот. Днк и рнк – черты сходства и различия состава, локализации в клетке, функции.
- •8. Вторичная структура днк (модель Уотсона и Крика). Связи, стабилизирующие вторичную структуру днк. Комплементарность. Правило Чаргаффа. Полярность. Антипараллельность.
- •9. Гибридизация нуклеиновых кислот. Денатурация и ренативация днк. Гибридизация (днк-днк, днк-рнк). Методы лабораторной диагностики, основанные на гибридизации нуклеиновых кислот.
- •10. Третичная структура днк. Роль гистоновых и негистоновых белков в компактизации днк. Организация хроматина. Ковалентная модификация гистонов и ее роль в регуляции структуры и активности хроматина.
- •11. Репликация. Принципы репликации днк. Стадии репликации. Инициация. Белки и ферменты, принимающие участие в формировании репликативной вилки.
- •12. Элонгация и терминация. Ферменты. Асимметричный синтез днк. Фрагменты Оказаки. Роль днк-лигазы в формировании непрерывной отстающей цепи.
- •13. Теломерная днк. Синтез теломерной днк.
- •14. Повреждения и репарация днк. Виды повреждений. Способы репарации. Дефекты репарационных систем и наследственные болезни.
- •16. Элонгация, терминация транскрипции (ρ-независимая, ρ-зависимая терминация)
- •17. Особенности транскрипции у эукариот. Структура белков, регулирующих процесс транскипции.
- •15. Транскрипция у прокариот. Характеристика компонентов системы синтеза рнк. Структура днк-зависимой рнк-полимеразы: роль субъединиц (α2ββ′δ). Инициация процесса.
- •18. Первичный транскрипт и его процессинг. Рибозимы как пример каталитической активности нуклеиновых кислот. Биороль.
- •19. Регуляция транскрипции у прокариот. Теория оперона, регуляция по типу индукции и репрессии (примеры).
- •2. Индукция синтеза белков. Lac-оперон
- •3. Репрессия синтеза белков. Триптофановый и гистидиновый опероны
- •20. Механизмы регуляции экспрессии генов у эукариот.
- •21. Постранскрипционная регуляция у эукариот, обеспечивающая разнообразие белков: альтернативный сплайсинг. Редактирование рнк.
- •22. Механизмы генетической изменчивости. Наследственные болезни
- •23. Биосинтез белков (трансляция). Основные компоненты белоксинтезирующей системы: аминокислоты, т-рнк, рибосомы, источники энергии, белковые факторы, ферменты.
- •24. Строение и функции рибосом. Связывающие и каталитическик центры рибосом.
- •25. Активация аминокислот. Аминоацил-т-рнк синтетазы, субстратная специфичность.
- •1. Субстратная специфичность
- •26. Сборка полипептидной цепи на рибосоме. Образование инициаторного комплекса у прокариот. Особенности стадии инициации у эукариот.
- •1. Инициация
- •2. Элонгация
- •3. Терминация
- •27. Элонгация: образование пептидной связи (р-ция транспептидации). Транслокация. Транслоказа. Терминация. Роль белковых факторов на каждой из стадий трансляции.
- •28. Регуляция биосинтеза белков на уровне трансляции. Изменение скорости трансляции.
- •Механизмы образования ковалентных связей
12. Элонгация и терминация. Ферменты. Асимметричный синтез днк. Фрагменты Оказаки. Роль днк-лигазы в формировании непрерывной отстающей цепи.
Элонгация
Факторы элонгации повышают активность РНК-полимеразы и облегчают расхождение цепей ДНК. Синтез молекулы РНК идёт от 5'- к З'-концу комплементарно матричной цепи ДНК. На стадии элонгации, в области транскрипционной
вилки, одновременно разделены примерно 18 нуклеотидных пар ДНК. Растущий конец цепи РНК образует временную гибридную спираль, около 12 пар нуклеотидных остатков, с матричной цепью ДНК. По мере продвижения РНК-полимеразы по матрице в направлении от 3'- к 5'-концу впереди неё происходит расхождение, а позади - восстановление двойной спирали ДНК.
Терминация
Раскручивание двойной спирали ДНК в области сайта терминации делает его доступным для фактора терминации. Завершается синтез РНК в строго определенных участках матрицы - терминаторах (сайты терминации). Фактор терминации облегчает отделение первичного транскрипта (пре-мРНК), комплементарного матрице, и РНК-полимеразы от матрицы. РНК-полимераза может вступить в следующий цикл транскрипции после присоединения субъединицы σ.
В каждой репликативной вилке идёт одновременно синтез двух новых (дочерних) цепей. Направление синтеза цепи ДНК совпадает с направлением движения репликативной вилки лишь для одной из вновь синтезируемых цепей (лидирующая цепь). На второй матричной цепи синтез дочерней ДНК осуществляется двумя ферментами: ДНК-полимеразой α и ДНК-полимеразой ε в направлении 5'→3', но против движения репликативной вилки. Поэтому вторая цепь синтезируется прерывисто, короткими фрагментами, которые называют "фрагменты Оказаки" (по имени открывшего их исследователя). Дочерняя цепь ДНК, синтез которой происходит фрагментами, называют отстающей цепью. Каждый фрагмент Оказаки, примерно 100 нуклеотидных остатков, содержит праймер. Праймеры удаляет ДНК-полимераза β, постепенно отщепляя с 3'-конца фрагмента по одному ри-бонуклеотиду. К ОН-группе на 3'-конце предыдущего фрагмента ДНК-полимераза β присоединяет дезоксирибонуклеотиды в количестве, равном вырезанному праймеру и таким образом заполняет брешь, возникающую при удалении рибонуклеотидов.
Фермент ДНК-лигаза катализирует образование фосфодиэфирной связи между 3'-ОН-группой дезоксирибозы одного фрагмента цепи ДНК и 5'-фосфатом следующего фрагмента. Реакция протекает с затратой энергии АТФ. Таким образом, из множества фрагментов Оказаки образуется непрерывная цепь ДНК.
13. Теломерная днк. Синтез теломерной днк.
Теломерная ДНК
На каждом конце хромосомы присутствует специфическая нуклеотидная последовательность. Она представлена многочисленными повторами (сотни или даже тысячи раз) олигонуклеотидов -GGGTTA-, называемых теломерной последовательностью, или просто теломерной ДНК. Наличие теломер необходимо для завершения репликации концевых информативных последовательностей хромосом, т.е. для сохранения генетической информации.
После завершения репликации хромосомы 5'-концы дочерних цепей ДНК недостроены, так как после удаления праймеров эти фрагменты оказываются недореплицированными. Это происходит потому, что ДНК-полимераза β, отвечающая за заполнение бреши, образованной после удаления праймера, не может вести синтез цепи ДНК от 3'- к 5'-концу (рис. 4-19, А). Таким образом, в ходе каждого цикла репликации 5'-концы синтезированных цепей укорачиваются. Но такие потери не представляют опасности для генетической информации хромосом, потому что укорочение ДНК идёт за счёт теломер. Во время следующего цикла репликации 5'-концы цепей ДНК опять остаются недостроенными. Таким образом, с каждым клеточным делением ДНК хромосом будут последовательно укорачиваться. Укорочение теломер в большинстве клеток по мере их старения - важный фактор, определяющий продолжительность жизни организма.
Однако в эмбриональных и других быстро-делящихся клетках потери концов хромосом недопустимы, потому что укорочение ДНК будет происходить очень быстро. В эукариотических клетках имеется фермент теломераза (нуклео-тидилтрансфераза), обеспечивающий восстановление недореплицированных 5'-концов. К особенностям этого фермента относят присутствие в качестве простетической группы РНК. Фрагмент РНК в активном центре теломеразы служит матрицей при синтезе теломер-ных повторов хромосом.
С помощью РНК фермент комплементарно прикрепляется к 3'-концу недостроенной дочерней цепи ДНК. Теломераза по принципу комплементарности последовательно удлиняет 3'-конец цепи ДНК на один гексануклеотид -GGGTTA-. Синтез всегда идёт от 5'- к 3'-концу. Затем теломераза смещается по цепи ДНК на один теломер и начинает синтез нового фрагмента -GGGTTA- (рис. 4-19, Б).
В большинстве соматических клеток теломераза неактивна, так как соматическая клетка имеет длину теломерной ДНК, достаточную для времени жизни клетки и её потомства. Однако небольшую активность теломеразы обнаруживают в клетках с высокой скоростью обновления, таких как лимфоциты, стволовые клетки костного мозга, клетки эпителия, эпидермиса кожи и др.
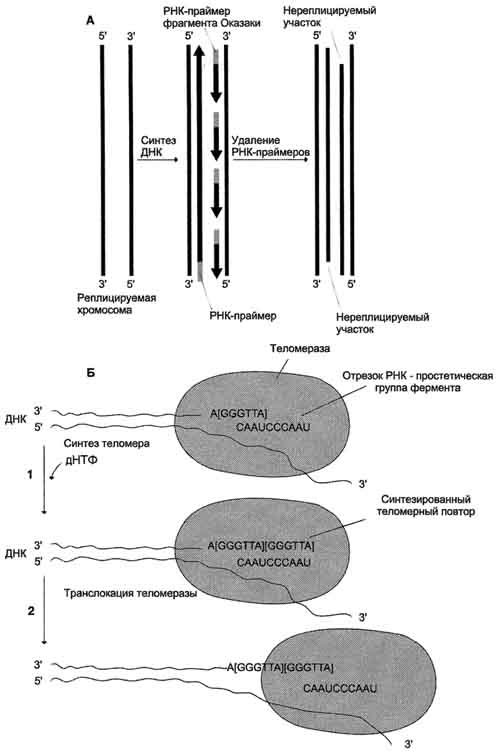
Рис. 4-19. Синтез теломерной ДНК. А - на рисунке показано укорочение вновь синтезированных цепей ДНК после удаления праймеров; Б - в состав теломеразы входит короткая молекула РНК, содержащая в активном центре последовательность нук-леотидов, комплементарную теломерному повтору; 1 - фермент прикрепляется за счёт взаимодействия РНК с существующей теломерой и добавляет последовательно по одному нуклеотиду фрагмент -GGGTTA-. Матрицей служит простетическая группа теломеразы - фрагмент РНК; 2 - фермент перемещается по нити ДНК таким образом, что РНК-матрица в составе теломеразы постоянно комплементарно связана с концом вновь синтезированного теломерного повтора. Заново синтезированная тело-мерная ДНК служит матрицей для удлинения второй цепи ДНК, но уже в ходе следующего цикла клеточного деления. Теломер-ный повтор на рисунке взят в квадратные скобки -[GGGTTA]-.
