
- •1. Общая схема синтеза и распада пиримидиновых нуклеотидов. Регуляция. Оротацидурия.
- •2. Общая схема синтеза и распада пуриновых нуклеотидов. Регуляция. Подагра.
- •3. Синтез дезоксирибонуклеотидов. Регуляция.
- •4. Общая схема распада нуклеиновых кислот, ферменты, субстраты, продукты.
- •7. Первичная структура нуклеиновых кислот. Днк и рнк – черты сходства и различия состава, локализации в клетке, функции.
- •8. Вторичная структура днк (модель Уотсона и Крика). Связи, стабилизирующие вторичную структуру днк. Комплементарность. Правило Чаргаффа. Полярность. Антипараллельность.
- •9. Гибридизация нуклеиновых кислот. Денатурация и ренативация днк. Гибридизация (днк-днк, днк-рнк). Методы лабораторной диагностики, основанные на гибридизации нуклеиновых кислот.
- •10. Третичная структура днк. Роль гистоновых и негистоновых белков в компактизации днк. Организация хроматина. Ковалентная модификация гистонов и ее роль в регуляции структуры и активности хроматина.
- •11. Репликация. Принципы репликации днк. Стадии репликации. Инициация. Белки и ферменты, принимающие участие в формировании репликативной вилки.
- •12. Элонгация и терминация. Ферменты. Асимметричный синтез днк. Фрагменты Оказаки. Роль днк-лигазы в формировании непрерывной отстающей цепи.
- •13. Теломерная днк. Синтез теломерной днк.
- •14. Повреждения и репарация днк. Виды повреждений. Способы репарации. Дефекты репарационных систем и наследственные болезни.
- •16. Элонгация, терминация транскрипции (ρ-независимая, ρ-зависимая терминация)
- •17. Особенности транскрипции у эукариот. Структура белков, регулирующих процесс транскипции.
- •15. Транскрипция у прокариот. Характеристика компонентов системы синтеза рнк. Структура днк-зависимой рнк-полимеразы: роль субъединиц (α2ββ′δ). Инициация процесса.
- •18. Первичный транскрипт и его процессинг. Рибозимы как пример каталитической активности нуклеиновых кислот. Биороль.
- •19. Регуляция транскрипции у прокариот. Теория оперона, регуляция по типу индукции и репрессии (примеры).
- •2. Индукция синтеза белков. Lac-оперон
- •3. Репрессия синтеза белков. Триптофановый и гистидиновый опероны
- •20. Механизмы регуляции экспрессии генов у эукариот.
- •21. Постранскрипционная регуляция у эукариот, обеспечивающая разнообразие белков: альтернативный сплайсинг. Редактирование рнк.
- •22. Механизмы генетической изменчивости. Наследственные болезни
- •23. Биосинтез белков (трансляция). Основные компоненты белоксинтезирующей системы: аминокислоты, т-рнк, рибосомы, источники энергии, белковые факторы, ферменты.
- •24. Строение и функции рибосом. Связывающие и каталитическик центры рибосом.
- •25. Активация аминокислот. Аминоацил-т-рнк синтетазы, субстратная специфичность.
- •1. Субстратная специфичность
- •26. Сборка полипептидной цепи на рибосоме. Образование инициаторного комплекса у прокариот. Особенности стадии инициации у эукариот.
- •1. Инициация
- •2. Элонгация
- •3. Терминация
- •27. Элонгация: образование пептидной связи (р-ция транспептидации). Транслокация. Транслоказа. Терминация. Роль белковых факторов на каждой из стадий трансляции.
- •28. Регуляция биосинтеза белков на уровне трансляции. Изменение скорости трансляции.
- •Механизмы образования ковалентных связей
1. Общая схема синтеза и распада пиримидиновых нуклеотидов. Регуляция. Оротацидурия.
Регуляторным ферментом в синтезе пиримидиновых нуклеотидов является полифункциональный КАД-фермент. УМФ и пуриновые нуклеотиды аллостерически ингибируют, а ФРДФ активирует его карбамоилсинтетазную активность, тогда как активность аспартаттранскарбамоилазного домена ингибирует ЦТФ, но активирует АТФ.
Этот способ регуляции позволяет предотвратить избыточный синтез не только УМФ, но и всех других пиримидиновых нуклеотидов и обеспечить сбалансированное образование всех четырёх основных пуриновых и пиримидиновых нуклеотидов, необходимых для синтеза РНК.
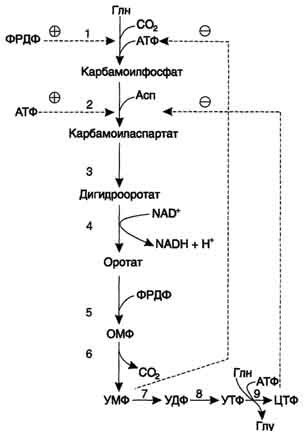
Регуляция синтеза пиримидиновых нуклеотидов. КАД-фермент катализирует реакции 1, 2, 3; дигидрооротатдегидрогеназа - реакцию 4; УМФ синтетаза - реакции 5 и 6; НМФ киназа - реакцию 7; НДФ киназа - реакцию 8; ЦТФ синтетаза - реацию 9.
Оротацидурия
Это единственное нарушение синтеза пиримидинов de novo. Оно вызвано снижением активности УМФ-синтазы, которая катализирует образование и декарбоксилирование ОМФ. Поскольку в эмбриогенезе от образования пиримидинов de novo зависит обеспечение синтеза ДНК субстратами, то жизнь плода невозможна при полном отсутствии активности этого фермента. Действительно, у всех пациентов с оротацидурией отмечают заметную, хотя и очень низкую активность УМФ-синтазы. Установлено, что содержание оротовои кислоты в моче пациентов (1 г/сут и более) значительно превосходит количество оротата, которое ежедневно синтезируется в норме (около 600 мг/сут). Снижение синтеза пиримидиновых нуклеотидов, наблюдающееся при этой патологии, нарушает регуляцию КАД-фермента по механизму ретроингибирования, из-за чего возникает гиперпродукция оротата.
Клинически наиболее характерное следствие оротацидурии - мегалобластная анемия, вызванная неспособностью организма обеспечить нормальную скорость деления клеток эритроцитарного ряда. Её диагностируют у детей на том основании, что она не поддаётся лечению препаратами фолиевой кислоты.
Недостаточность синтеза пиримидиновых нуклеотидов сказывается на интеллектуальном развитии, двигательной способности и сопровождается нарушениями работы сердца и ЖКТ. Нарушается формирование иммунной системы, и наблюдается повышенная чувствительность к различным инфекциям.
Гиперэкскреция оротовои кислоты сопровождается нарушениями со стороны мочевыводя-щей системы и образованием камней. При отсутствии лечения больные обычно погибают в первые годы жизни. При этом оротовая кислота не оказывает токсического эффекта. Многочисленные нарушения в работе разных систем организма вызваны "пиримидиновым голодом".
Для лечения этой болезни применяют уридин (от 0,5 до 1 г/сут), который по "запасному" пути превращается в УМФ.
Уридин + АТФ → УМФ + АДФ.
Нагрузка уридином устраняет "пиримидиновый голод", а поскольку из УМФ могут синтезироваться все остальные нуклеотиды пиримидинового ряда, то снижается выделение оротовои кислоты из-за восстановления механизма ретроингибирования КАД-фермента. Для больных оротацидурией лечение уридином продолжается в течение всей жизни, и этот нуклеозид становится для них незаменимым пищевым фактором.
Кроме генетически обусловленных причин, оротацидурия может наблюдаться:
при гипераммониемии, вызванной дефектом любого из ферментов орнитинового цикла,
за исключением карбамоилфосфат- синтетазы I. В этом случае карбамоилфосфат, синтезированный в митохондриях, выходит в цитозоль клеток и начинает использоваться на образование пиримидиновых нуклеотидов. Концентрация всех метаболитов, в том числе и оротовой кислоты, повышается. Наиболее значительная экскреция оротата отмечается при недостаточности орнитинкарбамоилтрансферазы (второго фермента орнитинового цикла);
в процессе лечения подагры аллопуринолом, который превращается в оксипуринолмононуклеотид и становится сильным ингибитором УМФ-синтазы. Это приводит к накоплению оротовой кислоты в тканях и крови.
