
- •Генетическое конструирование in vitro.(продолжение) Локализованный мутагенез.
- •Сайт-специфический мутагенез.
- •Олигонуклеотид-направленный мутагенез с использованием днк фага м13.
- •Олигонуклеотид-направленный мутагенез с использованием плазмидной днк.
- •Олигонуклеотид-направленный мутагенез с использованием полимеразной цепной реакции (пцр)-амплификации. (умножение числа отдельных генов или группы генов)
- •Случайный мутагенез с использованием аналогов нуклеотидов.
- •Генная инженерия белков.
- •Образование дополнительных дисульфидных связей.
- •Замена аспарагина на другие аминокислоты.
- •Уменьшение числа свободных сульфгидрильных групп.
- •Повышение ферментативной активности.
- •Изменение потребности ферментов в металлических кофакторах.
- •Изменение специфичности фермента.
- •Повышение стабильности и специфичности фермента.
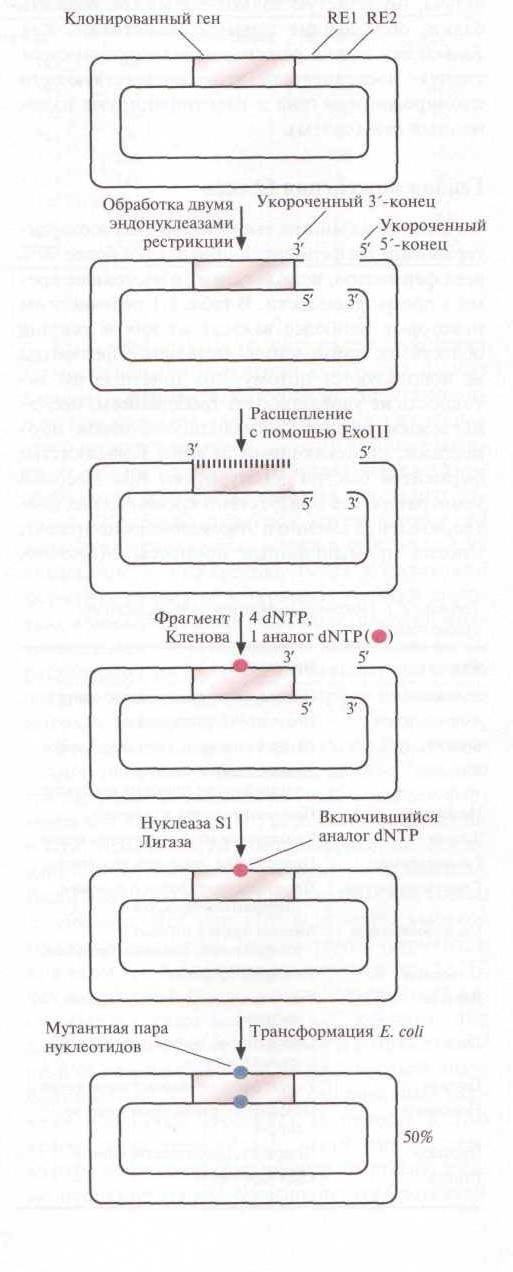
Случайный мутагенез с использованием аналогов нуклеотидов.
Ген-мишень встраивают в плазмиду поблизости от двух тесно расположенных сайтов рестрикции. Эти сайты подбирают так, чтобы после расщепления двумя рестриктазами образовывались укороченные 3’ и 5’-концы, а именно, чтобы 3’-конец сайта расщепления, расположенного рядом с клонированным геном, был укорочен, а 3’-конец с другой стороны плазмиды выступал. Экзонуклеаза III E. сoli (отщепляет нуклеотиды с 3’-концов двуцепочечной ДНК) расщепляет молекулу ДНК только с укороченных 3’-концов, но не с выступающих 3’- или любых 5’-концов. Ее добавляют в реакционную смесь после инкубирования ДНК с двумя рестриктазами, и она отщепляет от укороченного3’-конца цепи по одному нуклеотиду. Через определенное время реакцию останавливают и заполняют пробел с помощью ДНК-полимеразы, используя смесь обычных четырех дезоксирибонуклеотидов с добавлением аналога одного из них. В результате получают плазмиды, содержащие ген-мишень, в одном или нескольких сайтов которого находится аналог соответствующего нуклеотида. Ими трансформируют клетки E. сoli. Плазмиды реплицируются, и в клонированный ген включается нуклеотид, отличный от такового в исходном гене.
Генная инженерия белков.
Большое количество ферментов не используется потому, что присущая им активность не удовлетворяет требованиям, предъявляемым высокоспециализированными процессами, протекающими in vitro. Большинство ферментов быстро денатурируют при высокой температуре и в присутствии органических растворителей, а именно в этих условиях протекают многие промышленные процессы. Конечно, термостабильные ферменты можно выделить из термофильных микроорганизмов, однако эти организмы не всегда синтезируют именно те специфические ферменты, которые нужны.
Образование дополнительных дисульфидных связей.
Термостабильность белковых молекул можно повысить, внеся в них изменения, благодаря которым они дольше не разворачиваются при повышении температуры. Кроме того, такие термостабильные белки часто не разрушаются и при нефизиологических условиях (при экстремальных рН). К значительному повышению стабильности белковой молекулы может привести образование в не дисульфидных связей. Основная проблема здесь заключается в том, чтобы эти связи не мешали нормальному функционированию белка. Для этого два, четыре или шесть специфических аминокислотных остатков в полинуклеотидной цепи заменяют на остатки цистеина, в результате чего образовывалась одна, две или три дисульфидных связи соответственно.
Замена аспарагина на другие аминокислоты.
При высоких температурах остатки аспарагина и глутамина могут дезамидироваться с образованием аммиака. Теряя амидную группу, они превращаются в аспарагиновую и глутаминовую кислоты соответственно, что приводит к локальным изменениям конформации полипептидной цепи и как следствие – к утрате активности белков, в которые они входят.
Уменьшение числа свободных сульфгидрильных групп.
Чужеродный белок, синтезируемый в организме-хозяине, иногда оказывался менее активным, чем ожидалось, и чтобы повысить его активность, можно использовать методы генной инженерии. Например, при экспрессии в E. сoli клонированной комплементарной ДНК (кДНК) -интерферона человека (ИФ) белковый продукт обладал в 10 раз меньшей противовирусной активностью, чем нативная гликозилированная форма. При этом ИФ синтезировался в довольно большом количестве, однако почти все его молекулы образовывали димеры и более высокомолекулярные неактивные комплексы. Как показал анализ нуклеотидной последовательности гена ИФ, в нем присутствуют три остатка цистеина, и один из них или несколько, возможно, участвуют в образовании дисульфидных связей, приводящих к образованию димеров и олигомеров в клетках E. сoli, но не в клетках человека. Было высказано предположение, что замена одного или нескольких цистеиновых кодонов на сериновые приведет к синтезу интерферона, не образующего олигомеров. Серин был выбран потому, что его структура сходна со структурой цистеина за исключением того, что вместо серы он содержит кислород и потому не может образовывать дисульфидные связи.
