
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
“Ярославский государственный технический университет’’
Кафедра “Химическая технология органических веществ”
Задание защищено
Преподаватель
_______Г. В. Рыбина
2.04.13
Расчетно-графическое задание
по дисциплине «Теория химико-технологических процессов
органического синтеза»
раздел «Изучение кинетики сложных реакции»
ЯГТУ 240401.65 – 102 РГЗ
Работу выполнила
студентка гр. ХТО-40
_____В.Д. Бекреев
2.04.13
2013
Реферат
22 с., 20 таблиц, 3 источника
МЕХАНИЗМ РЕАКЦИИ, ПОРЯДОК РЕАКЦИИ, ЭНЕРГИЯ АКТИВАЦИИ, ПРЕДЭКСПОНЕНЦИАЛЬНЫЙ МНОЖИТЕЛЬ, КИНЕТИЧЕСКОЕ УРАВНЕНИЕ
В расчетно-графическом задании объектом исследования является кинетика химической реакции. Цель работы заключается в экспериментальном определении порядка и подтверждение его с помощью механизма исследуемой реакции. Эксперимент проводится на ЭВМ, обработка результатов производится с помощью средств Microsoft Excel. Принцип исследования на ЭВМ сводится к получению кинетических кривых накопления продуктов реакции во времени при разных начальных концентрациях исходных веществ при постоянной температуре реакции. В процессе работы были определены порядок реакции и параметры кинетического уравнения, а также рассчитаны предэкспоненциальный множитель и энергия активации.
|
|||||||||||
|
|
|
|
ЯГТУ 240401.65 - 102 РГЗ |
|||||||
|
|
|
|
||||||||
|
№документа |
Подп |
Дата |
||||||||
Зав. каф. |
А. В. Тарасов |
|
|
Теория химико-технологических процессов органического синтеза
|
Лит. |
Лист |
Листов |
||||
Нормок. |
|
|
|
|
У |
|
2 |
17 |
|||
Руковод. |
Г.В. Рыбина |
|
|
ЯГТУ гр. ХТО-40 |
|||||||
Консул. |
|
|
|
||||||||
Студент |
В.Д. Бекреев |
|
|
||||||||
Содержание
|
|
|||||||
|
№ документа |
Подпи |
Дата |
ЯГТУ.240401.65 - 102 РГЗ |
Стр. |
|||
Руковод. |
Г.В.Рыбина |
|
|
3 |
||||
Студент |
В.Д Бекреев |
|
|
|||||
Задача № 102
Реакция:
(С6Н5)2СНСl + CH3ОNa→ (С6Н5)2СНОСН3 +NaCl.
A Y B Z
Растворитель – СН3ОН.
Температура – 0 – 30 ˚С.
Реактор периодический, измеряется во времени вещество Y.
Пределы варьирования начальных концентраций:
А – от 0,3 до 3 моль/дм3;
Y – от 0,05 до 0,5 моль/дм3.
Необходимо:
Предположить механизм реакции;
Вывести кинетическое уравнение;
Составить план экспериментов;
Реализовать их на ЭВМ;
Найти параметры кинетического уравнения, обеспечивающие адекватное описание наблюдаемых зависимостей – предэкспоненциальный множитель и энергию активации реакции.
1 Определение порядка реакции
Предпологается, что реакция протекает по SN1 механизму, так как это типичный механизм вторичных алкилгалогенидов, которые имеют пространственные затруднения для механизма SN2, с нуклеофилами. Процесс делиться на две стадии, первая из которых подразумевает отделение галогена и образование карбокатиона. Полярный растворитель будет способствовать сольватации переходного состояния, по сравнению с исходным, также растворитель является протонным, что позволяет образовывать водородные связи с галогеном (анионом), стабилизируя его состояние. В качестве растворителя используется – метанол, с высокой диэлектрической проницаемостью.
Кинетическое
уравнение:
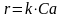 .
.
Опыт № 1
Опыт проводится при одинаковой начальной концентрации веществ А и Y, равной 0,4 моль/дм3, и при постоянной температуре 15 0С, интервал отбора проб 3 мин. Результаты эксперимента представлены в таблице 1.
Таблица 1 – Изменение концентрации во времени
-
№ отбора пробы
Время, мин
Концентрация Y, моль/дм3
1
0
0,4000
2
3
0,3852
3
6
0,3598
4
9
0,3373
5
12
0,3139
6
15
0,2980
7
18
0,2815
8
21
0,2649
Рассчитаем константу скорости реакции по уравнению первого и второго порядка.
Уравнение константы скорости первого порядка имеет вид:
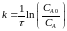 (1),
(1),
где τ – промежуток времени от начала реакции, мин;
САо – начальная концентрация вещества А, моль/дм3;
СА – текущая концентрация вещества А, моль/дм3.
При равных начальных концентрациях вещества А и Y текущая концентрация вещества А будет равна:
СА = САо – (СYo – CY) (2)
 моль/дм3;
моль/дм3;
При различных концентрациях вещества Y текущую концентрацию вещества А будем рассчитывать аналогично. Результаты приведены в таблице 2
Таблица 2 – Текущая концентрация вещества А при различных концентрациях вещества Y
-
№ отбора пробы
Концентрация Y, моль/дм3
Концентрация А, моль/дм3
1
0,4000
0,4000
2
0,3852
0,3852
3
0,3598
0,3598
4
0,3373
0,3373
5
0,3139
0,3139
6
0,2980
0,2980
7
0,2815
0,2815
8
0,2649
0,2649
Расчет константы скорости по уравнению первого порядка по форму-ле (1)

Расчет константы скорости по уравнению первого порядка через различный промежуток времени аналогичен, результаты представлены в таблице 3
Таблица 3 – Значение константы скорости по уравнению первого порядка через различный промежуток времени
-
№ отбора пробы
Время, мин
Константа скорости
 ,
мин-1
,
мин-11
0
2
3
0,01255
3
6
0,01767
4
9
0,01893
5
12
0,02019
6
15
0,01963
7
18
0,01951
8
21
0,01962
kср =0,0183 мин-1.
Уравнение константы скорости второго порядка имеет вид:
k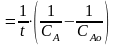 ,
(3)
,
(3)
где t – промежуток времени от начала реакции, мин;
САо – начальная концентрация вещества А, моль/дм3;
СА – текущая концентрация вещества А, моль/дм3.

Расчет константы скорости по уравнению второго порядка через различный промежуток времени аналогичен, результаты представлены в таблице 4
Таблица 4 – Значение константы скорости по уравнению второго порядка через различный промежуток времени
-
№ отбора пробы
Время, мин
Константа скорости , дм3/моль·мин-1
1
0
2
3
0,03198
3
6
0,04660
4
9
0,05160
5
12
0,05711
6
15
0,05705
7
18
0,05845
8
21
0,06071
kср = 0,0519 дм3/моль·мин-1.
Опыт № 2
Опыт проводится при начальной концентрации вещества А равной
0,6 моль/дм3 и начальной концентрации вещества Y равной 0,4 моль/дм3, при постоянной температуре 15 0С, интервал отбора проб 2 мин. Результаты эксперимента представлены в таблице 5.
Таблица 5 – Изменение концентрации во времени
-
№ отбора пробы
Время, мин
Концентрация Y, моль/дм3
1
0
0,4000
2
2
0,3814
3
4
0,3650
4
6
0,3209
5
8
0,3003
6
10
0,2999
7
12
0,2697
8
14
0,2552
Аналогично рассчитаем текущие концентрации вещества А по форму-ле (2).
 моль/дм3;
моль/дм3;
При различных концентрациях вещества Y текущую концентрацию вещества А будем рассчитывать аналогично. Результаты приведены в таблице 6
Таблица 6– Текущая концентрация вещества А при различных концентрациях вещества Y
-
№ отбора пробы
Концентрация Y, моль/дм3
Концентрация А, моль/дм3
1
0,4000
0,6000
2
0,3814
0,5814
3
0,3650
0,5650
4
0,3209
0,5209
5
0,3003
0,5003
6
0,2999
0,5999
7
0,2697
0,5697
8
0,2552
0,5552
Аналогично рассчитаем константу скорости реакции по уравнению первого порядка по формуле (1).

Расчет константы скорости по уравнению первого порядка через различный промежуток времени аналогичен, результаты представлены в таблице 7
Таблица 7 – Значение константы скорости по уравнению первого порядка через различный промежуток времени
-
№ отбора пробы
Время, мин
Константа скорости , мин-1
1
0
2
2
0,01579
3
4
0,01504
4
6
0,02357
5
8
0,02272
6
10
0,01826
7
12
0,02041
8
14
0,01973
kср = 0,01936 мин-1.
 Уравнение
константы скорости второго порядка при
различных начальных концентрациях А и
Y,
имеет вид:
Уравнение
константы скорости второго порядка при
различных начальных концентрациях А и
Y,
имеет вид:

Где t – промежуток времени от начала реакции, мин;
САо – начальная концентрация вещества А, моль/дм3;
СА – текущая концентрация вещества А, моль/дм3;
СYo – начальная концентрация вещества Y, моль/дм3;
СY – текущая концентрация вещества Y, моль/дм3.
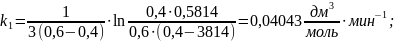
Расчет константы скорости по уравнению второго порядка через различный промежуток времени аналогичен, результаты представлены в таблице 8
Таблица 8 – Значение константы скорости по уравнению второго порядка через различный промежуток времени
-
№ отбора пробы
Время, мин
Константа скорости , дм3/моль·мин-1
1
0
2
2
0,04043
3
4
0,03936
4
6
0,06583
5
8
0,06562
6
10
0,05277
7
12
0,06223
8
14
0,06187
kср = 0,05544 дм3/моль·мин-1.
Опыт № 3
Опыт проводится при начальной концентрации вещества А равной
0,3 моль/дм3 и начальной концентрации вещества Y равной 0,4 моль/дм3, при постоянной температуре 15 0С, интервал отбора проб 4 мин. Результаты эксперимента представлены в таблице 9.
Таблица 9 – Изменение концентрации во времени
-
№ отбора пробы
Время, мин
Концентрация Y, моль/дм3
1
0
0,4000
2
4
0,3739
3
8
0,3486
4
12
0,3191
5
16
0,3192
6
20
0,2723
7
24
0,2816
8
28
0,2652
Аналогично рассчитаем текущие концентрации вещества А по форму-ле (2).
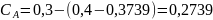 моль/дм3;
моль/дм3;
При различных концентрациях вещества Y текущую концентрацию вещества А будем рассчитывать аналогично. Результаты приведены в таблице 10
Таблица 10– Текущая концентрация вещества А при различных концентрациях вещества Y
-
№ отбора пробы
Концентрация Y, моль/дм3
Концентрация А, моль/дм3
1
0,4000
0,3000
2
0,3739
0,2739
3
0,3486
0,2486
4
0,3191
0,2191
5
0,3192
0,2192
6
0,2723
0,1723
7
0,2816
0,1816
8
0,2652
0,1652
Расчет константы скорости реакции для первого порядка рассчитываем по формуле (1):
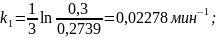
Расчет константы скорости по уравнению первого порядка через различный промежуток времени аналогичен, результаты представлены в таблице 11
Таблица 11 – Значение константы скорости по уравнению первого порядка через различный промежуток времени
-
№ отбора пробы
Время, мин
Константа скорости , мин-1
1
0
2
4
0,02278
3
8
0,02350
4
12
0,02620
5
16
0,01963
6
20
0,02774
7
24
0,02091
8
28
0,02130
kср = 0,02315 мин-1.
Расчет константы скорости второго порядка по уравнению (4):

Расчет константы скорости по уравнению второго порядка через различный промежуток времени аналогичен, результаты представлены в таблице 12
Таблица 12 – Значение константы скорости по уравнению второго порядка через различный промежуток времени
-
№ отбора пробы
Время, мин
Константа скорости , дм3/моль·мин-1
1
0
2
4
0,05892
3
8
0,06302
4
12
0,07361
5
16
0,05513
6
20
0,08502
7
24
0,06288
8
28
0,06627
При расчете kср не учитываем результаты второй и третьей пробы
kср = 0,06641 дм3/моль·мин-1.
Результаты трех опытов представлены в таблице 13.
Таблица 13 – Результаты эксперимента
№ опыта |
САо, моль/дм3 |
СYo, моль/дм3 |
Константа скорости k |
|
1-ый порядок, мин-1 |
2-ой порядок, дм3∙моль-1∙мин-1 |
|||
1 |
0,4 |
0,4 |
0,01830 |
0,05193 |
2 |
0,6 |
0,4 |
0,01936 |
0,05544 |
3 |
0,3 |
0,4 |
0,02315 |
0,06641 |
Средняя
константа скорости первого порядка
равна kср= 0,0203 .
.
Константа скорости, рассчитанная по уравнению первого порядка, имеет наименьшие погрешности, то есть отклонения среднего значения от значения полученного при каждой точке отбора проб, а это значит что зависимость первого порядка лучше описывает процесс. Результаты расчёта погрешностей представлены в таблице 14.
Это в своё время означает, что изучаемая реакция, является реакцией первого порядка и протекает по механизму мономолекулярного нуклеофильного замещения SN1.
Уравнение скорости реакции имеет вид [ 3 ]:
r = А·e-E/RT·CA.
Таблица 14 – Результаты расчёта погрешностей для первого опыта
№ отбора пробы |
Значения погрешностей для константы скорости первого порядка |
Значения погрешностей для константы скорости второго порядка |
Константа скорости k |
|
1-ый порядок, мин-1 |
2-ой порядок, дм3∙моль-1 ∙мин-1 |
|||
1 |
3,30∙10-5 |
3,98∙10-4 |
|
|
2 |
3,99∙10-7 |
2,84∙10-5 |
0,01255 |
0,03198 |
3 |
3,96∙10-7 |
1,11∙10-7 |
0,01767 |
0,04660 |
4 |
3,57∙10-6 |
2,69∙10-5 |
0,01893 |
0,05160 |
5 |
1,76∙10-6 |
2,62∙10-5 |
0,02019 |
0,05711 |
6 |
1,47∙10-6 |
4,25∙10-5 |
0,01963 |
0,05705 |
7 |
1,75∙10-6 |
7,72∙10-5 |
0,01951 |
0,05845 |
8 |
4,24∙10-5 |
5,99∙10-4 |
0,01962 |
0,06071 |
Сумма |
4,24∙10-5 |
5,99∙10-4 |
0,01830 |
0,05193 |
Для остальных опытов результаты приводят к тому же выводу.
