
- •Лекция №10. Свойства оксосоединений (альдегидов и кетонов)
- •Медленно
- •4.Присоединение спиртов:
- •6.Взаимодействие с аммиаком:
- •7.Образование оксимов с гидроксиламином:
- •10. Реакции конденсации альдегидов, приводящие к образованию альдолей, называют альдольной конденсацией (а).
- •Карбоновые кислоты. Общие и специфические свойства
- •Предельные Непредельные
- •Методы получения
- •2.Оксосинтез. R-ch2-ch2-cooh
- •4. Гидролиз тригалогенпроизводных:
- •Физические свойства карбоновых кислот
- •Обзор важнейших реакций карбоновых кислот
- •1.Диссоциация:
- •2.Взаимодействие с активными металлами:
- •3. Реакция нейтрализации:
1.Диссоциация:
RCOOH + H2O RCOO- + H3O+
Карбоновые кислоты изменяют окраску индикаторов( лакмуса, метилового оранжевого в красный цвет).
2.Взаимодействие с активными металлами:
2RCOOH + Mg (RCOO)2Mg + H2
3. Реакция нейтрализации:
RCOOH + OH- RCOO- + H2O
Натриевые и калиевые соли карбоновых кислот имеют ионный характер, растворяются в воде и нерастворимы в органических растворителях. Это обстоятельство можно использовать для перевода кислоты из раствора в органическом растворителе, не смешивающемся с водой, в водную фазу.
Карбоновые кислоты вступают в другие реакции, характерные для кислот: взаимодействие с оксидами металлов (4), обменные реакции (5) - вытеснение солей более слабых кислот:
4. СаО + 2RCOOH (RCOO)2Ca + H2O
5. Na2CO3 + 2RCOOH 2RCOONa + CO2 + H2O
Реакции ОН-группы: этерификация, образование ангидридов и хлорангидридов. Эти и другие реакции кислот представлены на схеме 1.
Реакция этерификации относится к наиболее важным в органической химии. Механизм реакции состоит в протонировании карбоновой кислоты, затем нуклеофильная атака образовавшегося катиона спиртом, перемещение протона, отщепление воды и депротонирование получившегося эфира:
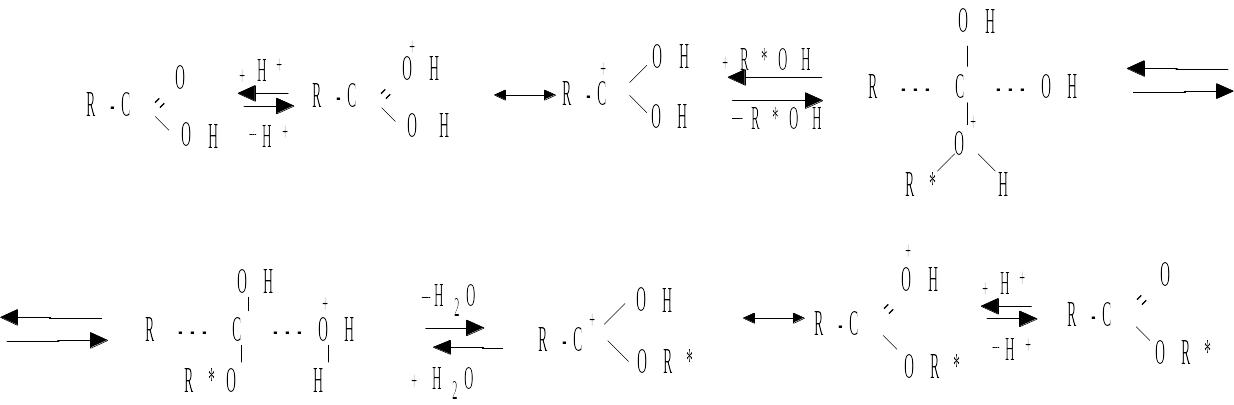
При прохождении этапов реакции в обратном порядке эфир под действием воды и минеральной кислоты гидролизует до смеси кислоты и спирта. Этот процесс можно осуществлять и под действием щелочи, что называется омылением.
Под действием PCI3, PCI5, SOCI2 карбоновые кислоты образуют очень реакционноспособные хлорангидриды кислот: RCOCI. При реакции хлорангидридов с солями карбоновых кислот образуются также весьма реакционноспособные ангидриды кислот.
Реакции, характерные для карбонильной группы, затруднены. Гидрирование можно осуществить в очень жестких условиях. Карбоновые кислоты устойчивы по отношению к окислителям и восстановителям.
Специфические свойства проявляет в этом отношении муравьиная кислота, вступающая в реакцию” серебряного” и “медного” зеркала.
Реакции углеводородного радикала:
а/для предельных одноосновных кислот – образование -галогензамещенных кислот:
R-CH2-COOH + Br2 R-CHBr –COOH + HBr ( кипячение кислот в присутствии красного фосфора)
б/для непредельных кислот - реакции присоединения, окисления и полимеризации.Присоединение галогеноводородов к ненасыщенным кислотам с сопряженными двойными связями (-, -ненасыщенные кислоты) идет против правила Марковникова:
СН2=СН-СООН + НBr СН2Br –CH2-СООН
Карбоксильная группа стабильна к повышению температуры и отщепляет диоксид углерода лишь в исключительных случаях, например, у некоторых соответствующим образом замещенных кислот и некоторых дикарбоновых кислот. Такая реакция называется декарбоксилированием.
Поведение дикарбоновых кислот при нагревании
Результат нагревания дикарбоновых кислот зависит от взаимного расположения карбоксильных групп:
1. Декарбоксилирование (в случае близкого расположения карбоксильных групп ):
НОСО – СООН СО2 + НСООН
НООС – СН2 – СООН СО2 + СН3СООН
НООС-СНR-СООН СО2 + R-СН2СООН
алкилуксусная кислота
Одно- и двузамещенные гомологи малоновой кислоты используются для получения алкилуксусных кислот.
2. Дегидратация с образованием циклических ангидридов (для янтарной и глутаровой кислот):
СН2СООН СН2СО
Н2О + О
СН2СООН СН2СО
янтарный ангидрид
3. Декарбоксилирование и дегидратация с образованием циклических кетонов ( для адипиновой и других кислот с большим числом атомов углерода):
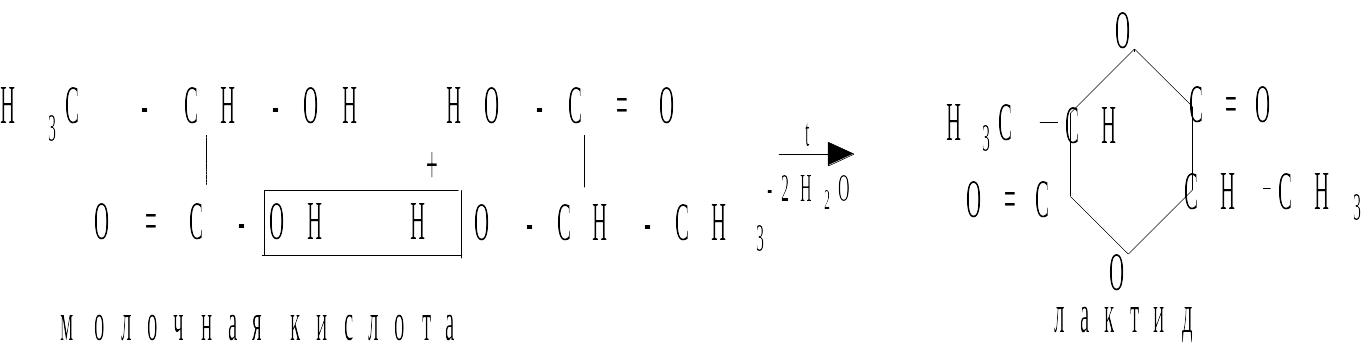
Поведение гидроксикислот при нагревании
-гидроксикислоты при нагревании отщепляют воду и образуют циклические сложные эфиры – лактиды, состоящие из остатков двух молекул:
-гидроксикислоты при нагревании образуют непредельные кислоты:
t
СН2 – СН – СООН СН2 =СН –СООН
ОН Н -Н2О
-гидроксипропионовая акриловая кислота
кислота
- и - Гидроксикислоты, отщепляя воду при нагревании, дают лактоны – внутренние сложные эфиры:
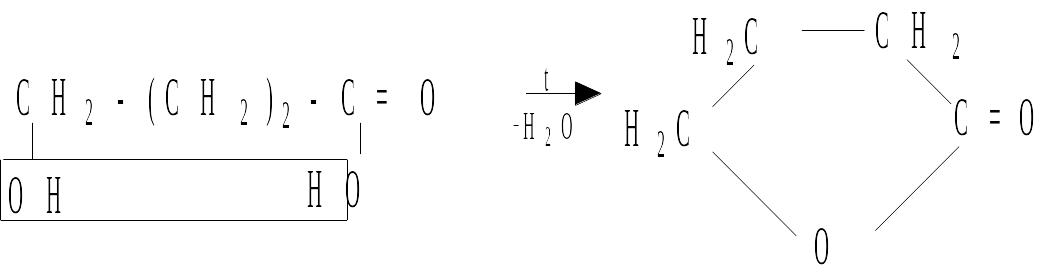
- гидроксимасляная лактон -гидроксимасляной кислоты
кислота (бутиролактон)
Из других специфических свойств - гидроксикислот следует отметить легкость восстанавливания в соответствующие карбоновые кислоты при действии иодоводорода:
СН2ОН – СООН + 2НI СН3СООН + Н2О + I2
Трикарбоновая оксикислота – лимонная – с концентрированной серной кислотой вступает в характерную для - оксикислот реакцию: происходит отщепление муравьиной кислоты ( сразу же разлагающейся на оксид углерода(II) и воду) с образованием дикарбоновой -кетокислоты. При более энергичной обработке можно получить ацетон.
