
- •Введение
- •Понятие об электродных потенциалах
- •1.2. Процессы, происходящие при погружении металла в воду
- •1.3. Процессы, происходящие при погружении металла в раствор собственной соли
- •Измерение электродных потенциалов. Водородный электрод.
- •3.Факторы, влияющие на величину электродного потенциала. Уравнение Нернста. Стандартный электродный потенциал.
- •4. Ряд стандартных электродных потенциалов (сэп)
- •5. Гальванический элемент
- •5.1. Гальванический элемент Даниэля-Якоби
- •Заключение
Измерение электродных потенциалов. Водородный электрод.
Абсолютные значения электродных потенциалов, которые характеризуют двойной электрический слой, измерить не удается, так как проводник, опущенный для измерения в раствор, сам создает свой двойной электрический слой.
В этом случае приходится измерять относительную разность потенциалов с каким-либо электродом, принимаемым за нулевую точку отчета.
На практике в качестве стандартного электрода используют не металл, а так называемый водородный электрод, потенциал которого воспроизводится с высокой точностью (рис.3).
Водородный электрод представляет собой платиновую пластинку, покрытую губчатой платиной и опущенную в раствор H2SO4 с активной концентрацией ионов водорода, равной 1 моль/л.
Через раствор пропускают водород под давлением 1 атм (101,3 кПа)
На границе раздела платиновой пластинки и серной кислоты идет процесс:
2 H+
+ 2e
2H0
H2
H+
+ 2e
2H0
H2
Потенциал
водородного электрода
 принимается равным нулю.
принимается равным нулю.
Схематично
водородный электрод изображается
следующим образом:


Схема стандартного водородного электрода:
Платиновый электрод.
Подводимый газообразный водород.
Раствор кислоты (обычно HCl), в котором концентрация H+ = 1 моль/л.
Водяной затвор, препятствующий попаданию кислорода воздуха.
Электролитический мост (состоящий из концентрированного р-ра KCl), позволяющий присоединить вторую половину гальванического элемента.
Электродный потенциал такого электрода зависит от концентрации ионов водорода в растворе, от давления водорода в газовой фазе и от температуры.
3.Факторы, влияющие на величину электродного потенциала. Уравнение Нернста. Стандартный электродный потенциал.
В результате измерения электродных потенциалов металлов Е при различных условиях установили, что их величина зависит:
1) от природы веществ – участников электродного процесса;
2) от концентраций растворов, в которые погружены электроды;
3) от температуры системы.
Зависимость электродного потенциала Е от перечисленных факторов выражается уравнением Нернста:
E
= E +
+
 ,
где:
,
где:
R – универсальная газовая постоянная
T – абсолютная температура, К;
n – число электронов, принимающих участие в процессе на границе металл-раствор, численно равная заряду катиона в растворе;
[Men+] – молярная концентрация (при точных вычислениях – активность) ионов металла в растворе, моль/л;
E - так называемый стандартный электродный потенциал.
E
= Е
при
 = 0 то есть при [Men+]
1 моль/л.
= 0 то есть при [Men+]
1 моль/л.
Разность потенциалов, измеряемая при погружении металла в раствор собственного иона с активной концентрацией 1 моль/л относительно стандартного водородного электрода, потенциал которого при 25 С условно принимается равным нулю, называется стандартным электродным потенциалом данного металла E (СЭП).
При подстановке всех констант и при стандартной температуре Т = 25 + 273 = 298К получим приведенное уравнение Нернста:
 ,
или:
,
или:
 .
.
Задача. Рассчитать электродный потенциал медного электрода, погруженного в раствор собственной соли:
а)
Молярная концентрация катионов меди
(II)
в растворе
 составляет
0,01 (10-2)
моль/л;
составляет
0,01 (10-2)
моль/л;
б) = 1 моль/л.
а)
 .
.
б)
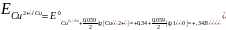 .
.
