
- •1. Теоретическая часть
- •1.1. Электронные потенциалы
- •1.1.1. Электродвижущие силы
- •1.1.2. Простые и сложные электроды
- •1.1.3. Коррозионный гальванический элемент
- •1.1.4. Электрохимическая неоднородность металлической поверхности. Механизмы растворения металла
- •1.2. Протекание электричества
- •1.2.1. Кинетика электродных процессов
- •1.2.3. Закономерности анодного растворения металлов
- •1.2.4. Механизм и кинетика катодного выделения водорода
- •1.2.5. Механизм и кинетика ионизации кислорода
- •1.2.6. Анализ работы коррозионного гальванического элемента
- •1.2.7. Контролирующий процесс
- •1.2.8. Контактная коррозия металлов
- •1.2.9. Защитные покрытия
- •2. Экспериментальная часть Работа 1. Перенапряжение выделения водорода
- •Работа 2. Контактная коррозия металлов
- •Работа 3. Электролитическое никелированиесталей
- •Работа 4. Анодирование алюминия
- •Библиографический список
- •394026 Воронеж, Московский просп., 14
1.2.5. Механизм и кинетика ионизации кислорода
Коррозию металлов с ассимиляцией электронов растворенными в электролите кислородом называют процессом коррозии с кислородной деполяризацией. С кислородной деполяризацией корродируют металлы, находящиеся в атмосфере и почве, соприкасающиеся с водой и водными растворами солей. Этот вид коррозии является самым распространенным.
Процесс включает несколько стадий:
1. Растворение кислорода воздуха в электролите (прохождение кислорода через поверхность раздела воздух-электролит).
2. Перенос кислорода через основную толщу электролита за счет механического перемешивания, конвекции и диффузии.
3. Диффузия кислорода через слой жидкости, прилегающий к катоду, или через пленку продуктов коррозии на металле к катодным участкам.
4. Ионизация кислорода:
а) в нейтральных и щелочных растворах
 ,
(19)
,
(19)
б) в кислых растворах
 .
(20)
.
(20)
5. Диффузия ионов ОНГ от катодных участков поверхности корродирующего металла в глубь электролита.
В большинстве случаев наиболее затрудненными стадиями катодного процесса являются: в спокойных электролитах – диффузия кислорода, а при больших скоростях подвода кислорода к корродирующему металлу – ионизация кислорода.
Разность
между равновесным потенциалом кислородного
электрода и потенциалом катода при
прохождении тока составляет величину
перенапряжения ионизации кислорода
 :
:
 .
(21)
.
(21)
Перенапряжение ионизации кислорода связано с плотностью тока следующим соотношением:
 ,
(22)
,
(22)
где
 определяется только механизмом катодной
реакции,
определяется только механизмом катодной
реакции,
 зависит от материала катода и численно
равен перенапряжению при плотности
тока, равной 1 мА/Ом2.
зависит от материала катода и численно
равен перенапряжению при плотности
тока, равной 1 мА/Ом2.
1.2.6. Анализ работы коррозионного гальванического элемента
Анализ работы коррозионного гальванического элемента С точки зрения электрохимического механизма потеря вещества при коррозии пропорциональна величине коррозионного тока:
m = kJ (23)
где m – потеря массы металла;
к – коэффициент пропорциональности.
Скорость электрохимической коррозии можно выразить через плотность коррозионного тока:
 ,
(24)
,
(24)
где Sa – поверхность анодных участков.
При равномерной коррозии Sa = SMe, где SMe – общая поверхность корродирующего металла. Таким образом, расчет скорости электрохимической коррозии сводится к расчету коррозионного тока J.
Для графического расчета скорости коррозионного процесса пользуются коррозионной диаграммой (рис. 7). Коррозионной диаграммой называют зависимость потенциалов анода и катода от силы тока. При этом по оси абсцисс откладывают силу тока, а по оси ординат – соответствующие значения потенциалов анода и катода.
В случае короткозамкнутого элемента (R = 0) анодная и катодная кривые пересекаются в точке S. Этой точке на оси абсцисс отвечает значение максимального коррозионного тока Jmax, а на оси ординат – общий стационарный потенциал двухэлектродной системы Ех. Из данной коррозионной диаграммы можно также найти графически значения анодной ΔЕа и катодной ΔЕк поляризаций.
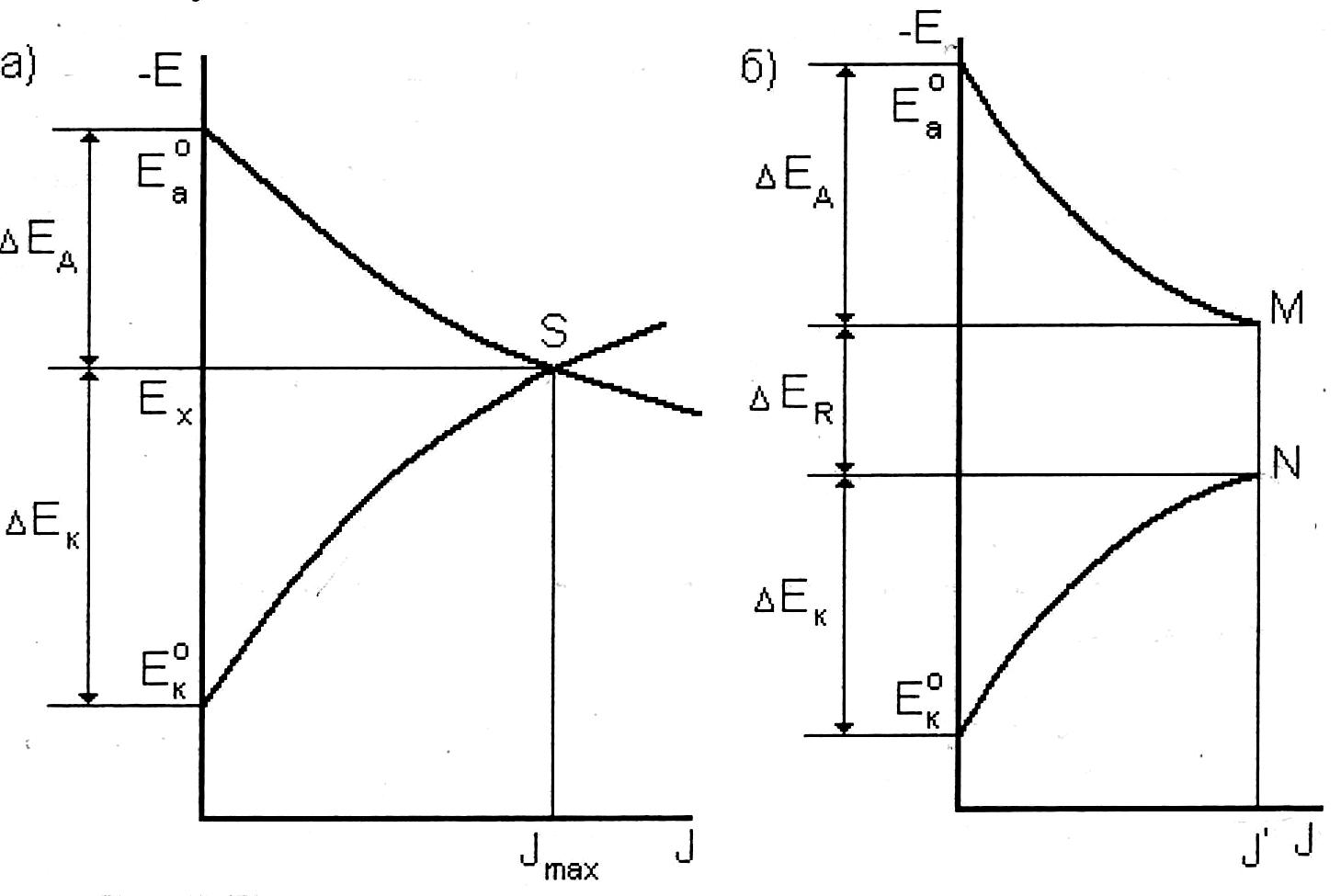
Рис. 7. Поляризационные коррозионные диаграммы:
a)
R
= 0 и б) R
 0
0
Если омическое сопротивление корродирующей двухэлектродной системы не равно нулю, то кривые Еа = f(J)
и Ек = f(J) не сольются. Коррозионная диаграмма (рис. 7, б) дает значения анодной ΔЕа , катодной ΔЕк поляризации и омического падения потенциала ΔЕR при силе коррозионного тока J'.
