
- •1. Теоретическая часть
- •1.1. Электронные потенциалы
- •1.1.1. Электродвижущие силы
- •1.1.2. Простые и сложные электроды
- •1.1.3. Коррозионный гальванический элемент
- •1.1.4. Электрохимическая неоднородность металлической поверхности. Механизмы растворения металла
- •1.2. Протекание электричества
- •1.2.1. Кинетика электродных процессов
- •1.2.3. Закономерности анодного растворения металлов
- •1.2.4. Механизм и кинетика катодного выделения водорода
- •1.2.5. Механизм и кинетика ионизации кислорода
- •1.2.6. Анализ работы коррозионного гальванического элемента
- •1.2.7. Контролирующий процесс
- •1.2.8. Контактная коррозия металлов
- •1.2.9. Защитные покрытия
- •2. Экспериментальная часть Работа 1. Перенапряжение выделения водорода
- •Работа 2. Контактная коррозия металлов
- •Работа 3. Электролитическое никелированиесталей
- •Работа 4. Анодирование алюминия
- •Библиографический список
- •394026 Воронеж, Московский просп., 14
1.2.3. Закономерности анодного растворения металлов
Анодный процесс является ответственным за коррозионные потери металла. В процессах коррозии выделяются три фактора, обусловливающие поляризацию анода:
1. Химическая поляризация, которая связана с трудностями протекания анодной реакции ионизации металла:
.
2. Концентрационная поляризация, обусловленная трудностями ионов, накапливающихся у поверхности анода, тем больше его потенциал смещается в электроположительную сторону. Но обычно продукты коррозии обладают малой растворимостью, поэтому доля концентрационной поляризации очень небольшая.
3. Пассивирование анода. Многие металлы при наличии в растворе окислителей способны образовывать защитные пленки – становиться пассивными. Скорость растворения металла резко падает. Потенциал, при котором происходит такой переход, называется потенциалом пассивации. Присутствие в растворе ионов хлора, сульфатных или иных анионов часто вызывает пробой оксидной пленки, что ведет к росту плотности тока на отдельных участках. Поверхность в этих местах подвергается интенсивному растворению, образуя небольшие очаги поражения – питтинги. При подходящих условиях питтинги могут сливаться, и тогда травление распространяется на всю поверхность металла, приводя к выравниванию местных дефектов и общему сглаживанию поверхности – электрополировке.
Если подбор условий позволяет избегнуть питтингообразования и потенциал продолжает возрастать без видимых признаков нарушения пассивного состояния, то новый подъем скорости растворения вызывает так называемая перепассивация, когда в раствор переходят ионы наивысшей валентности металла.
Наконец, при потенциалах, превышающих равновесный потенциал кислородного электрода, увеличение плотности тока будет происходить за счет окисления воды с выделением кислорода:
 .
(12)
.
(12)
Легче всего этот процесс протекает на металлах, чьи окисные пленки обладают высокой электронной проводимостью. Если же электронная проводимость оксидных пленок мала, то анодный процесс приведет к увеличению толщины оксидной пленки. Такое течение процесса называют анодным оксидированием. Все эти разнообразные пути протекания анодного процесса представлены на рис. 6 в виде полного графика анодной поляризации, где 1 – активное растворение металла; 2 – область пассивации; 3 – пассивное состояние; 4 – питтингообразование; 5 – электрополировка; 6 – перепассивация; 7 – анодное выделение кислорода; 8 – анодное оксидирование; iкр – критический ток пассивации; iпacc – ток в пассивном состоянии; Еп – потенциал пассивации; Ef – потенциал активации; Епр – потенциал пробоя; Епп – потенциал перепассивации; ЕО2 – потенциал начала выделения 02.

Рис. 6. График анодной поляризации
1.2.4. Механизм и кинетика катодного выделения водорода
Коррозия металлов в кислых средах часто сопровождается процессом выделения водорода. Этот процесс носит название водородной деполяризации и протекает на катодных участках корродирующей поверхности металла. Коррозия с водородной деполяризацией имеет место в тех случаях, когда активность ионов водорода в растворе достаточно велика, потенциал металла достаточно электроотрицателен или по своей природе, или же из-за очень низкой с водородной деполяризацией возможно, если активности ионов металла в растворе. Следовательно, протекание коррозии металла с водородной деполяризацией возможно если,
 ,
(13)
,
(13)
где , (14)
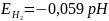 ,
(15)
,
(15)
 – равновесный
потенциал металла;
– равновесный
потенциал металла;
 – равновесный
водородный потенциал.
– равновесный
водородный потенциал.
Общая реакция разряда ионов водорода на катодных участках
 .
(16)
.
(16)
В кислых средах она протекает по следующим стадиям:
1. Диффузия ионов гидроксония Н30+ к катоду.
2. Разряд ионов гидроксония с образованием адсорбированного атома водорода:
 .
.
3. Рекомбинация (молизация) атомов водорода:
 .
.
4. Образование и отрыв пузырька водорода от катода.
Установлено, что в большинстве случаев стадией, тормозящей процесс катодного выделения водорода, является вторая – процесс разряда ионов водорода. Для некоторых металлов (группы железа и платины) основной тормозящей стадией может быть третья – рекомбинация. Остальные ступени, как правило, не оказывают существенного влияния на катодный процесс. Затруднения в процессе выделения водорода, связанные с разрядом его ионов или рекомбинацией его атомов, требует для их преодоления дополнительной энергии, поэтому в действительности разряд ионов водорода протекает при более отрицательном потенциале, чем равновесный водородный потенциал .
Разность между потенциалом равновесного (обратимого) водородного электрода в данном растворе и значением потенциала катода, при котором реально происходит процесс выделения водорода, носит название водородного перенапряжения η:
 .
(17)
.
(17)
Перенапряжение зависит от катодной плотности тока, материала катода, температуры и других факторов. При плотностях тока свыше 10–4 А/см2 перенапряжение выделения водорода описывается уравнением Тафеля
 ,
(18)
,
(18)
где константа а определяется природой катода. Ее физический смысл состоит в том, что она равна перенапряжению при плотности тока в 1 А/см2. Константа b практически не зависит от материала катода, ее значение при 25 °С близко 0,12 В.
Перенапряжение водорода имеет большое значение в процессах коррозии металлов с водородной деполяризацией. Чем больше величина перенапряжения водорода, тем меньше скорость коррозионного процесса.
