
- •1. Теоретическая часть
- •1.1. Электронные потенциалы
- •1.1.1. Электродвижущие силы
- •1.1.2. Простые и сложные электроды
- •1.1.3. Коррозионный гальванический элемент
- •1.1.4. Электрохимическая неоднородность металлической поверхности. Механизмы растворения металла
- •1.2. Протекание электричества
- •1.2.1. Кинетика электродных процессов
- •1.2.3. Закономерности анодного растворения металлов
- •1.2.4. Механизм и кинетика катодного выделения водорода
- •1.2.5. Механизм и кинетика ионизации кислорода
- •1.2.6. Анализ работы коррозионного гальванического элемента
- •1.2.7. Контролирующий процесс
- •1.2.8. Контактная коррозия металлов
- •1.2.9. Защитные покрытия
- •2. Экспериментальная часть Работа 1. Перенапряжение выделения водорода
- •Работа 2. Контактная коррозия металлов
- •Работа 3. Электролитическое никелированиесталей
- •Работа 4. Анодирование алюминия
- •Библиографический список
- •394026 Воронеж, Московский просп., 14
1.2. Протекание электричества
1.2.1. Кинетика электродных процессов
Рассмотрим, как меняется ток коррозионного элемента во времени. При замыкании цепи гальванического элемента начальное значение электрического тока соответствует закону Ома:
 ,
(10)
,
(10)
где Е – ЭДС элемента;
 и
и
 – стационарные электродные электродные
потенциалы соответственно катода и
анода;
– стационарные электродные электродные
потенциалы соответственно катода и
анода;
R – омическое сопротивление.
Если омическое сопротивление пары R мало, то начальное значение величины тока Jн после замыкания цепи быстро падает и через определенное время устанавливается равным какой-то устойчивой величине J, значительно меньшей первоначальной. Так как R во времени существенным образом не изменяется, то наблюдаемое уменьшение силы тока можно объяснить только изменением потенциала электродов:
 .
(11)
.
(11)
Здесь Ек и Еа – эффективные потенциалы электродов при установившемся значении J.
Уменьшение начальной разности потенциалов электродов гальванического элемента вследствие прохождения через него тока называется поляризацией гальванического (в частном случае коррозионного) элемента. Если разность потенциалов уменьшилась, следовательно, изменились значения потенциалов анода и катода. Всякое отклонение потенциала электрода от его равновесного значения называется электродной поляризацией.
В коррозионном элементе поляризация обусловлена тем, что перемещение электронов совершается быстрее, чем электродные реакции. При анодном процессе скорость перехода ионов металла в раствор будет отставать от скорости отвода электронов от анода, и на электроде будет скапливаться избыток положительных зарядов. Потенциал анода смещается в положительную сторону. При катодной поляризации, наоборот, на электрод поступают добавочные электроны, которые по причине запаздывания их ассимиляции деполяризатором будут смещать потенциал катода в отрицательную сторону.
Поляризация тормозит работу гальванического и, в частности, коррозионного элемента. Электродный процесс, уменьшающий поляризацию, принято называть деполяризацией, а вещества, прибавление которых препятствует поляризации, – деполяризаторами.
Из изложенного выше следует, что по степени смещения потенциала при протекании тока определенной плотности через электрод (т.е. по степени поляризуемости электрода) можно судить о легкости протекания электродного процесса.
Если смещение потенциала на единицу повышения плотности тока небольшое, то электродный процесс мало тормозится и протекает с заметной скоростью. Наоборот, при сильной поляризуемости (большом смещении потенциала на единицу изменения плотности тока) происходит большое торможение электродного процесса и скорость его мала. О кинетике (скорости) мы можем, следовательно, судить по зависимости потенциала электрода от плотности протекающего тока. Эта зависимость, выраженная графически, называется поляризационной кривой (рис. 5).
 ,
,
 – средние
поляризуемости анода и катода.
– средние
поляризуемости анода и катода.
 ,
,
 – истинные
анодная и катодная поляризуемости.
– истинные
анодная и катодная поляризуемости.
Поляризационные кривые имеют большое значение для объяснения основных закономерностей коррозионных процессов. Экспериментальное построение и изучение поляризационных кривых – один из основных методов выяснения механизма коррозионного процесса.
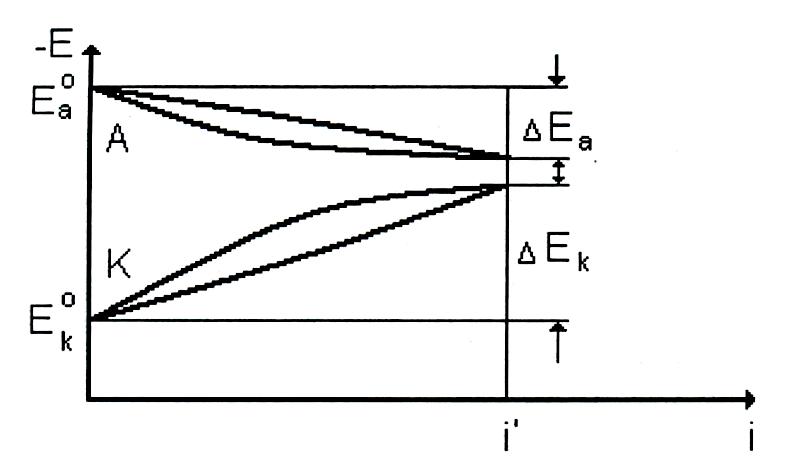
Рис. 5. Поляризационные кривые:
А
– анодной; К – катодной поляризации.
 и
– стационарные
и
– стационарные
потенциалы анода и катода соответственно при i = 0
