
- •Министерство образования и науки российской федерации
- •Содержание:
- •Кинематика поступательного и вращательного движения
- •Динамика поступательного и вращательного движения.
- •Работа. Энергия
- •Законы сохранения в механике
- •Элементы специальной теории относительности
- •Средняя энергия молекул
- •Распределения Максвелла и Больцмана
- •Первое начало термодинамики
- •Второе начало термодинамики. Энтропия.
- •Электростатическое поле в вакууме
- •Законы постоянного тока
- •Магнитостатика
- •Явление электромагнитной индукции
- •Электрические и магнитные свойства вещества
- •Свободные и вынужденные колебания
- •Сложение гармонических колебаний
- •Волны. Уравнение волны
- •Энергия волны. Перенос энергии волной
- •Уравнения Максвелла
- •Интерференция и дифракция света
- •Поляризация и дисперсия света
- •Тепловое излучение. Фотоэффект
- •Эффект Комптона. Световое давление
- •Дуализм свойств микрочастиц. Соотношение неопределенностей Гейзенберга
- •Спектр атома водорода. Правило отбора
- •Уравнение Шредингера
- •Ядерные реакции
- •Ядро. Элементарные частицы
- •Фундаментальные взаимодействия.
Первое начало термодинамики
№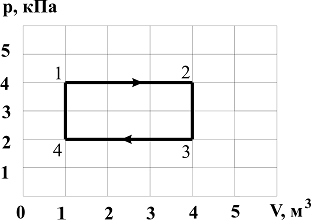 1
Диаграмма
циклического процесса идеального
одноатомного газа представлена на
рисунке. Отношение работы при нагревании
газа к работе при охлаждении по модулю
равно …
1
Диаграмма
циклического процесса идеального
одноатомного газа представлена на
рисунке. Отношение работы при нагревании
газа к работе при охлаждении по модулю
равно …
Ответ 2
№2
При
изотермическом расширении 0,5 моля
газа при температуре 200 К
объем увеличился в
 раз
(
раз
(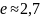 ).
Работа газа (в Дж)
равна …
).
Работа газа (в Дж)
равна …
Решение:
При
изотермическом расширении газа работа
находится по формуле:

№ 3
В процессе, представленном на рисунке,
работа идеального одноатомного газа
(в
кДж)
при
нагревании равна
3
В процессе, представленном на рисунке,
работа идеального одноатомного газа
(в
кДж)
при
нагревании равна
Решение:
Работа газа в координатных осях
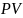 численно
равна площади под графиком функции.
Работа при нагревании совершается в
процессе
численно
равна площади под графиком функции.
Работа при нагревании совершается в
процессе
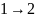 .
.
 .
.
№ 4
Диаграмма
циклического процесса идеального
одноатомного газа представлена на
рисунке. Работа газа за цикл (в кДж)
равна …
4
Диаграмма
циклического процесса идеального
одноатомного газа представлена на
рисунке. Работа газа за цикл (в кДж)
равна …
Решение:
Работу
газа в циклическом процессе можно найти,
определив площадь, ограниченную кривой
цикла в координатах p,
V
Цикл имеет форму трапеции. Тогда
 .
.
№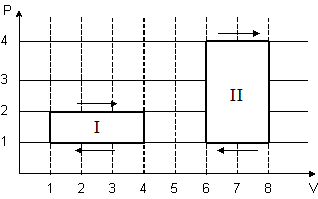 5
На
(P,V)-диаграмме
изображены 2 циклических процесса.
5
На
(P,V)-диаграмме
изображены 2 циклических процесса.
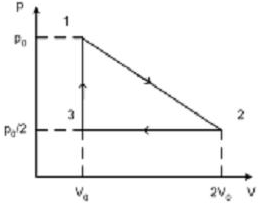
Отношение
работ
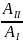 , совершенных в этих циклах, равно
, совершенных в этих циклах, равно
Ответ 2.
№ 6
На
рисунке изображен цилиндрический
процесс, происходящий с одним молем
двухатомного идеального газа. Газ
совершает работу только за счет
полученного извне тепла на участке …
6
На
рисунке изображен цилиндрический
процесс, происходящий с одним молем
двухатомного идеального газа. Газ
совершает работу только за счет
полученного извне тепла на участке …
Решение.
Из
графика видно, что газ получает теплоту
в процессах 1-2 и 3-1. Переход 3-1 осуществляется
при постоянном объеме, следовательно,
работа газа
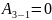 . Из графика видно, что точки 1 и 2 лежат
на одной изотерме, т.к.
. Из графика видно, что точки 1 и 2 лежат
на одной изотерме, т.к.
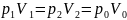 ; следовательно,
; следовательно,
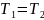 и изменение внутренней энергии
и изменение внутренней энергии
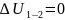 . По
началу термодинамики для
процесса 1-2 количество теплоты равно:
. По
началу термодинамики для
процесса 1-2 количество теплоты равно:
 , т.е.
газ совершает работу за счет полученного
извне тепла.
Процесс 2-3 является изобарным сжатием,
газ передает тепло внешней среде.
, т.е.
газ совершает работу за счет полученного
извне тепла.
Процесс 2-3 является изобарным сжатием,
газ передает тепло внешней среде.
№7 При увеличении давления в 3 раза и уменьшении объема в 2 раза внутренняя энергия идеального газа….
Решение.
Внутренняя
энергия идеального газа равна
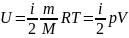 (учитываем, что
(учитываем, что
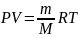 ), где
), где
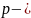 давление,
давление,
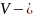 объем,
полное
число степеней свободы,
объем,
полное
число степеней свободы,
 универсальная
газовая постоянная,
абсолютная
температура,
универсальная
газовая постоянная,
абсолютная
температура,
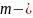 масса
газа,
масса
газа,
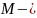
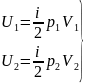 Учитывая, что
Учитывая, что
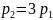 ,
,
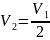 , получаем
, получаем
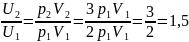 .
Следовательно,
.
Следовательно,
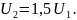
Ответ. Увеличится в 1,5 раза
№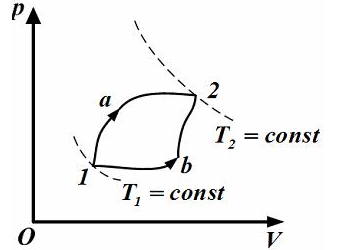
 8
Идеальный
газ переводится из первого состояния
во второе двумя способами(1а2 и 1b2)
,как показано на рисунке.Теплота,полученная
газом,изменение внутренней энергии и
работа газа при переходе его из одного
состояния в другое связаны соотношениями…
8
Идеальный
газ переводится из первого состояния
во второе двумя способами(1а2 и 1b2)
,как показано на рисунке.Теплота,полученная
газом,изменение внутренней энергии и
работа газа при переходе его из одного
состояния в другое связаны соотношениями…
Решение.
При
любом способе перехода идеального газа
из первого состояния во второе,согласно
первому началу термодинамики,теплота,сообщаемая
газу,расходуется на изменение его
внутренней энергии и на совершение им
работы против внешних сил:
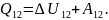 При
этом изменение внутренней энергии,как
однозначной функции термодинамического
состояния системы,
При
этом изменение внутренней энергии,как
однозначной функции термодинамического
состояния системы,
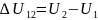 не зависит от способа перехода и
определяется только разностью значений
внутренней энергии этих состояний:
не зависит от способа перехода и
определяется только разностью значений
внутренней энергии этих состояний:
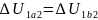 .
Работа
.
Работа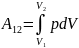 ,
совершаемая газом при изменение его
объема от
,
совершаемая газом при изменение его
объема от
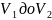 ,
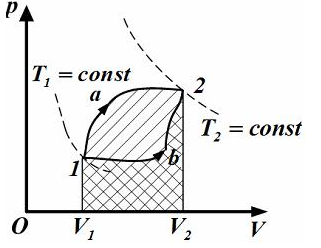
зависит от процесса перехода. Величина
этой работы равна площади фигуры под
графиком процесса в кординатных осях
p,V(см.рис.).
,
зависит от процесса перехода. Величина
этой работы равна площади фигуры под
графиком процесса в кординатных осях
p,V(см.рис.).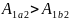 ,
так как площади заштрихованных фигур
,
так как площади заштрихованных фигур
 .
Следовательно по первому закону
термодинамики:
.
Следовательно по первому закону
термодинамики:
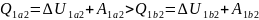 .
Теплота,полученая газом ,изменение
внутренней энергии и работа газа при
переходе его из одного состояния в
другое связы соотношениями:
.
Теплота,полученая газом ,изменение
внутренней энергии и работа газа при
переходе его из одного состояния в
другое связы соотношениями: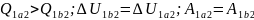 .
.
№9 Если при коэффициенте полезного действия тепловой машины 80 %, рабочее тело отдает холодильнику 200 Дж тепла, то получает от нагревателя ____ Дж тепла
Решение:
Коэффициент
полезного действия тепловой машины
определяется по формуле
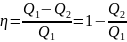 ,
где
,
где
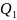 – количество теплоты, полученное рабочим
телом от нагревателя;
– количество теплоты, полученное рабочим
телом от нагревателя;
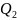 – количество теплоты, отданное
рабочим телом холодильнику.
– количество теплоты, отданное
рабочим телом холодильнику.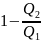 =0,8,
=0,8,
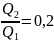 ,
,
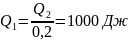 .
.
№10 Идеальному газу сообщается одинаковое количество теплоты при изохорном (1), изобарном (2) и изотермическом (3) процессах. Для совершаемых газом работ справедливы соотношения …
Ответ
 .
.
№11
Одноатомному
идеальному газу в результате изобарического
процесса подведено количество теплоты
 . На увеличение внутренней энергии газа
расходуется часть теплоты
. На увеличение внутренней энергии газа
расходуется часть теплоты
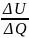 , равная …
, равная …
Ответ 0,6
