
- •Федеральное агентство по образованию
- •Рецензенты:
- •Предисловие
- •Введение
- •Часть I. Основные классы химических соединений, входящие в состав живой материи глава 1. Белки
- •1.1. Функции белков
- •1.2. Аминокислотный состав белков
- •1.3.Структурная организация белков
- •1.4. Физико-химические свойства белков
- •1.5. Классификация белков
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 2. Нуклеиновые кислоты
- •2.1. Химический состав нуклеиновых кислот
- •2.2. Структура нуклеиновых кислот
- •2.2.1. Структура днк
- •2.2.2. Структура рнк
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 3. Ферменты
- •3.1. Классификация ферментов и номенклатура
- •3.2. Активный центр ферментов
- •3.3. Механизм действия ферментов
- •3.4. Кинетика ферментативных реакций
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 4. Витамины
- •4.1. Классификация витаминов
- •4.2. Витамины, растворимые в жирах
- •4.3. Витамины, растворимые в воде
- •4.4. Витаминоподобные вещества
- •4.5. Антивитамины
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 5. Углеводы
- •5.1. Классификация углеводов
- •5.2. Моносахариды
- •Моносахариды
- •5.3. Олигосахариды
- •5.4. Полисахариды
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 6. Липиды
- •6.1. Классификация липидов
- •6.2. Жирные кислоты
- •6.3. Глицериды
- •6.4. Воска
- •6.5. Фосфолипиды
- •6.6. Гликолипиды (гликосфинголипиды)
- •6.7. Стероиды
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 7. Гормоны
- •7.1. Классификация гормонов
- •7.2. Гормоны гипоталамуса
- •7.3. Гормоны гипофиза
- •7.3.3. Гормоны передней доли гипофиза.
- •7.4. Гормоны паращитовидных желез (паратгормоны)
- •7.5. Гормоны щитовидной железы
- •7.6. Гормоны поджелудочной железы
- •7.7. Гормоны надпочечников
- •7.8. Половые гормоны
- •7.9. Гормоны вилочковой железы
- •7.10. Гормоны насекомых
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 8. Молекулярные механизмы гормонального сигнала
- •8.1. Механизм действия стероидных гормонов
- •8.2. Механизм действия гормонов пептидной природы
- •Вопросы и задачи
- •Рекомендуемая литература
- •Часть II. Обмен веществ и энергии в организме
- •Глава 9. Обмен нуклеиновых кислот
- •9.1. Синтез пуриновых нуклеотидов.
- •9.2. Синтез пиримидиновых нуклеотидов
- •9.3. Биосинтез нуклеиновых кислот (биосинтез днк)
- •Распад нуклеиновых кислот
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 11. Обмен белков
- •10.1. Пути распада белков
- •10.2. Судьба всосавшихся аминокислот
- •10.3. Обезвреживание аммиака в организме
- •10.4. Биосинтез белка
- •Генетический кодовый «словарь»
- •10.4.1. Этапы синтеза белка
- •10.5. Регуляция синтеза белка
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 11. Обмен углеводов
- •11.1. Переваривание и всасывание углеводов
- •11.2. Синтез и распад гликогена
- •11.3. Окисление глюкозы
- •11.3.1. Гликолиз
- •Глюкоза Молочная кислота (2 мол)
- •11.3.2. Цикл Кребса
- •11.3.3. Цепь переноса электронов
- •11.4. Глюконеогенез
- •11.5. Пентозофосфатный путь окисления глюкозы
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 12. Обмен липидов
- •12.1. Переваривание и всасывание липидов
- •12.2. Окисление жирных кислот
- •12.3. Биосинтез жирных кислот
- •12.3.1. Биосинтез насыщенных жирных кислот
- •12.3.2. Биосинтез ненасыщенных жирных кислот
- •12.3.3. Синтез триглицеридов
- •12.3.4. Биосинтез холестерина
- •12.4. Нарушения липидного обмена
- •12.4.1. Ожирение
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 13. Биологическое окисление
- •13.1. Ферменты, катализирующие окислительно-восстановительные реакции
- •13.2. Классификация процессов биологического окисления
- •13.2.1. Свободное окисление
- •13.2.2. Окисление, сопряженное с фосфорилированием адф
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 14. Взаимосвязь процессов обмена веществ
- •Вопросы и задачи
- •Рекомендуемая литература
- •Библиографический список
- •Глава12. Обмен липидов 127
- •Глава13 . Биологическое окисление 141
- •Глава14. Взаимосвязь обмена веществ 145
1.4. Физико-химические свойства белков
К физико-химическим свойствам относятся высокая вязкость растворов, незначительная диффузия, способность к набуханию в больших пределах, оптическая активность, подвижность в электрическом поле, низкая осмотическая активность и высокое онкотическое давление, способность к поглощению УФ-лучей при 280 нм.
Белки, как и аминокислоты, амфотерны благодаря наличию свободных NH2- и COОH-групп. Для них характерны все свойства кислот и оснований. В зависимости от реакции среды и соотношения кислых (аспарагиновая, глутаминовая) и основных аминокислот (аргинин, лизин, гистидин) белки в растворе несут или отрицательный или положительный заряд, перемещаясь к аноду или катоду.
Значения рН, при котором как аминная, так и карбоксильная группы заряжены и эти заряды скомпенсированы, называют изоэлектрической точкой (ИЭТ, pI). ИЭТ каждого белка определяется соотношением кислых и основных групп. Если же аминокислота содержит дополнительные ионогенные группировки, то при расчете pI следует учитывать их вклад.
Изоэлектрическая точка большинства белков животных тканей лежит в пределах от 5,5 до 7,0, что свидетельствует о частичном преобладании кислых аминокислот. В природе существуют белки, у которых значения изоэлектрических точек лежат в крайних значениях рН среды. Например, величина pI пепсина равна 1, а сальмина почти 12.
В изоэлектрической точке белки наименее устойчивы в растворе и легко выпадают в осадок. pL белка в сильной степени зависит от присутствия в растворе ионов солей; в то же время на ее величину не влияет концентрация белка.
Белки обладают ярко выраженными гидрофильными свойствами. Растворы белков имеют очень низкое осмотическое давление, высокую вязкость и незначительную способность к диффузии. Белки способны к набуханию в очень больших пределах. Молекулы белков не способны проникать через полупроницаемые мембраны (целлофан, пергамент, коллодий), а также биомембраны растительных и животных тканей.
Д
Рис.
7. Денатурация и ренатурация белковой
молекулы
(рибонуклеазы)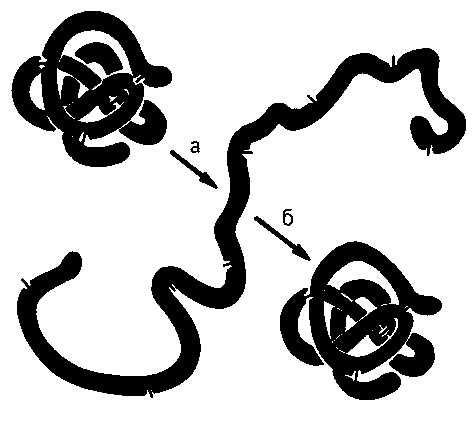
При денатурации происходит потеря характерных для белка свойств (растворимость, электрофоретическая подвижность, биологическая активность и т.д.). При непродолжительном действии и быстром удалении денатурирующих агентов возможна ренатурация белка с полным восстановлением исходной трехмерной структуры и нативных свойств его молекул.
1.5. Классификация белков
В зависимости от химического состава белки делятся на простые и сложные.
Простые белки или протеины (франц. рroteine, греч. protos первый) состоят только из остатков аминокислот. Среди них выделяют несколько групп, которые характеризуются определенными свойствами и функциями. Некоторые из них приведены в таблице 2.
Таблица 2
Группы простых белков
Белки |
Свойства |
Примеры |
Прота- мины |
Обладают выраженными основными свойствами, хорошо растворимы в воде. Изоэлектрическая точка находится в щелочной среде (рН 10 13) |
Сальмин, клупеин (выделены из молок семги). Протамины составляют белковый компонент в структуре ряда сложных белков |
Гистоны |
Белки основного характера. Изоэлектрическая точка находится в щелочной среде (рН 8 11) |
Сосредоточены в ядрах клетки, играют важную роль в упаковке ДНК и регуляции экспрессии генов |
Прола- мины и глютелины |
Белки растительного происхождения; растворимы в 60-80%-ном водном растворе этанола, в то время как другие белки выпадают в осадок |
Содержатся в семенах злаков, составляют основную массу клейковины. Оризенин (из риса), глютенин, глиадин (из пшеницы), зеин (из кукурузы), гордеин (из ячменя) |
Альбу- мины |
Простые глобулярные белки, хорошо растворимы в воде, солевых растворах, разбавленных кислотах и щелочей; выпадают в осадок при насыщении раствора сульфатом аммония выше 50% |
Лактальбумин (молоко), овальбумин (яичный белок), сывороточный альбумин (сыворотка крови), основные резервные белки организма |
Глобу- лины |
Глобулярные белки, растворимы в разбавленных растворах солей, кислот и щелочей; слаборастворимы в воде. Выпадают в осадок при насыщении раствора сульфатом аммония выше 50% |
Входят в состав растительных и животных тканей. Составляют почти половину белков сыворотки крови. Некоторые глобулины связаны с углеводами, липидами, НК и определяют иммунные свойства организма (антитела, свертываемость крови и т.д.) |
Сложные белки или протеиды (франц. protos первый, важнейший, греч. eidos вид) – сложные белки, содержащие небелковый компонент – простетическую группу (греч. prostheto присоединяю).
В зависимости от химической природы простетической группы сложные белки подразделяют на следующие классы: хромопротеиды (в состав входят пигменты); нуклеопротеиды (содержат нуклеиновые кислоты); липопротеиды (содержат липиды); фосфопротеиды (содержат фосфорную кислоту); гликопротеды (содержат углеводы); металлопротеиды (содержат металлы).
Хромопротеиды (от chroma- цвет, краска) – сложные окрашенные белки, содержащие в своем составе простетическую группу, определяющую спектр поглощения белка и его цвет. Хромопротеиды играют исключительно важную роль в процессах жизнедеятельности. В зависимости от структуры простетической группы хромопротеиды разделяют на гемопротеиды, флавопротеиды, фикобилины, ретинилиденпротеиды и др.
К группе гемопротеидов относятся гемоглобин и его производные, миоглобин, хлорофиллсодержащие белки, ферменты (цитохрооксидазная система, каталаза, пероксидаза). В этих соединениях в качестве небелкового компонента выступает железо (магний) порфирин, а в качестве белкового компонента – разные по структуре и функциям белки. Гемоглобин, например, содержит белок глобин, а небелковый компонент – гем. Гем является простетической группой и у миоглобина, каталазы, пероксидазы, цитохромов. Гемоглобины участвуют в транспорте кислорода от легких к тканям; легко соединясь с другими газами, гемоглобин теряет способность связываться с кислородом.
Гемопротеиды принимают участие в таких процессах как дыхание, фотосинтез, транспорт кислорода, углекислого газа, окислительно-восстановительных реакциях, свето- и цветовосприятии и т.д.
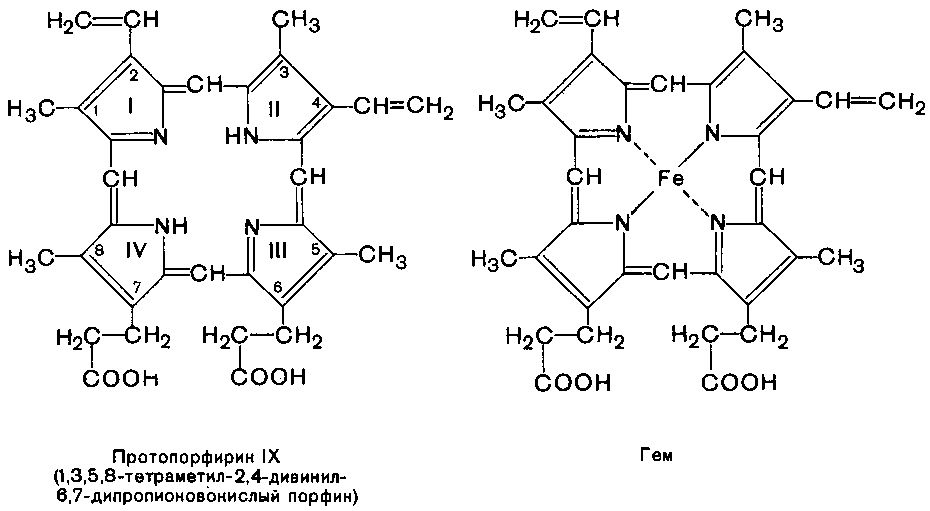
Хлорофиллы содержат магнийпорфирины и обеспечивают фотосинтетическую активность растений, катализируя расщепление молекулы воды на водород и кислород.
Миоглобин (белок мышц) связывает переносимый гемоглобином кислород и передает его окислительным системам клеток.
Цитохромы являются переносчиками электронов и содержатся во всех клетках организмов; локализованы в мембранах митохондрий, хлоропластов, хроматофоров и других мембранных структурах. Они принимают участие во всех основных группах окислительно-восстановительных процессов, протекающих в живых организмах – дыхании, фотосинтезе, микросомальном окислении.
К хромопротеинам относятся и флавопротеиды, простетическими группами у которых являются изоаллоксазиновые производные – ФМН (флавинмононуклеотид) и ФАД (флавинадениндинуклеотид) (см. раздел «Ферменты»). Флавопротеиды входят в состав оксидоредуктаз – ферментов, катализирующих окислительно-восстановительные реакции в клетке.
Фикобилины (пигменты красных водорослей и цианобактерии) содержат в составе небелковой части хромофорную группу, являющуюся аналогом желчных кислот. Пигменты участвуют в процессе фотосинтеза.
Нуклеопротеиды представляют собой сложные комплексы нуклеиновых кислот с белками. По характеру НК, входящей в состав нуклеопротеидов, различают дезоксинуклеопротеид (ДНП) и рибонуклеопротеид (РНК). ДПН содержатся в ядрах клеток, митохондриях. Белки в ДНП представлены гистонами и протаминами, расположенными в желобах двойной спирали ДНК. Белки стабилизируют структуру ДНП и регулируют ее матричную активность. Из РНП состоят рибосомы, вирусные частицы; РНП обнаружены также в ядре, ядрышках.
Липопротеиды – комплекс белков и липидов. Липопротеиды широко распространены в живых организмах и выполняют разнообразные функции. Они составляют структурную основу всех биологических мембран, в свободном состоянии присутствуют в основном в плазме крови и лимфе. Занимают ключевое положение в транспорте и метаболизме липидов. Липопротеиды (ЛП) плазмы крови классифицируются в зависимости от электрофоретической подвижности и плотности при электроцентрифугировании (табл. 3). Различают ЛП низкой плотности (ЛПНП), очень низкой плотности (ЛПОНП), высокой плотности (ЛПВП), очень высокой плотности (ЛПОВП) и ЛП промежуточной плотности (ЛППП).
Отклонение в содержании какого-либо класса ЛП в крови от нормы диагностируется с нарушением липидного обмена. Например, повышенное содержание ЛПОНП сочетается с диабетом, ожирением, ишемической болезнью сердца.
Таблица 3
Классификация и свойства ЛП сыворотки крови человека
Электрофоретическая фракция |
Фракция при ультрацентрифугировании |
Плотность, г/см3 |
Процент белка |
Липидный комплекс |
Хиломи- кроны |
- |
0,96 |
1-2 |
Свободные жирные кислоты |
Пре--ЛП |
ЛПОНП |
0,96-1,006 |
7 |
То же |
2-1-ЛП |
ЛППП |
1,006-1,019 |
11 |
Эфиры холестерина |
-ЛП |
ЛПНП |
1,019-1,063 |
21-23 |
То же |
1-ЛП |
ЛПВП |
1,063-1,200 |
35-50 |
Фосфолипиды |
1-ЛП |
ЛПОВП1 |
1,2110 |
65 |
Свободные жирные кислоты |
Альбумин |
ЛПОВП2 |
1,210 |
97 |
То же |
Гликопротеиды – сложные белки, содержащие углеводы (от долей % до 80%). М.м. 15000-1000000. Присутствуют во всех тканях животных, растений, микроорганизмов. К гикопротеидам относятся белки секретов слизистых оболочек желез (муцин), опорных тканей (мукоиды), белки плазмы крови (церуллоплазмин, трансферрин, фибриноген, иммуноглобулины), интерфероны, гормоны (эритропоэтин, тиреотропин), структурные белки клеточных мембран и т.д. Все гликопротеиды выполняют специфические функции: обеспечивают клеточную адгезию, молекулярное и клеточное узнавание, защитные и гормональные активизирующие действия.
Металлопротеиды – сложные белки, содержащиеся в качестве необходимой составной части атомы металлов (железо, марганец, медь, цинк и другие). В транспортных и запасающих металлопротеидах (трансферрин, церулоплазмин) связь металла с белком обычно непрочная. В состав других металлопротеидов (фермен- тов – оксидоредуктазы, карбоангидразы) входят прочно связанные атомы металлов, удаление которых нарушает строение и функциональные свойства металлопротеидов. Многочисленные ферменты, относящиеся к металлопротеидам, требуют для проявления активности наличия в среде определенных катионов (например, маг- ния – для фосфотрансферазы; калия, магния для пируваткиназы).
Фосфопротеиды – сложные глобулярные белки, содержащие фосфатные группы, присоединенные обычно к остаткам серина и треонина полипептидной цепи. Широко распространены в живых организмах. Выполняют разнообразные функции: участвуют в регуляции активности ядра, окислительных процессах в митохондриях, транспорте ионов в клетке. Являются ценными источниками энергетического и пластического материала в процессе эмбриогенеза и дальнейшего развития организма. К фосфопротеидам относятся казеин молока, вителлин яичного желтка, ихтулин икры рыб и др.
