
- •Федеральное агентство по образованию
- •Рецензенты:
- •Предисловие
- •Введение
- •Часть I. Основные классы химических соединений, входящие в состав живой материи глава 1. Белки
- •1.1. Функции белков
- •1.2. Аминокислотный состав белков
- •1.3.Структурная организация белков
- •1.4. Физико-химические свойства белков
- •1.5. Классификация белков
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 2. Нуклеиновые кислоты
- •2.1. Химический состав нуклеиновых кислот
- •2.2. Структура нуклеиновых кислот
- •2.2.1. Структура днк
- •2.2.2. Структура рнк
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 3. Ферменты
- •3.1. Классификация ферментов и номенклатура
- •3.2. Активный центр ферментов
- •3.3. Механизм действия ферментов
- •3.4. Кинетика ферментативных реакций
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 4. Витамины
- •4.1. Классификация витаминов
- •4.2. Витамины, растворимые в жирах
- •4.3. Витамины, растворимые в воде
- •4.4. Витаминоподобные вещества
- •4.5. Антивитамины
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 5. Углеводы
- •5.1. Классификация углеводов
- •5.2. Моносахариды
- •Моносахариды
- •5.3. Олигосахариды
- •5.4. Полисахариды
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 6. Липиды
- •6.1. Классификация липидов
- •6.2. Жирные кислоты
- •6.3. Глицериды
- •6.4. Воска
- •6.5. Фосфолипиды
- •6.6. Гликолипиды (гликосфинголипиды)
- •6.7. Стероиды
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 7. Гормоны
- •7.1. Классификация гормонов
- •7.2. Гормоны гипоталамуса
- •7.3. Гормоны гипофиза
- •7.3.3. Гормоны передней доли гипофиза.
- •7.4. Гормоны паращитовидных желез (паратгормоны)
- •7.5. Гормоны щитовидной железы
- •7.6. Гормоны поджелудочной железы
- •7.7. Гормоны надпочечников
- •7.8. Половые гормоны
- •7.9. Гормоны вилочковой железы
- •7.10. Гормоны насекомых
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 8. Молекулярные механизмы гормонального сигнала
- •8.1. Механизм действия стероидных гормонов
- •8.2. Механизм действия гормонов пептидной природы
- •Вопросы и задачи
- •Рекомендуемая литература
- •Часть II. Обмен веществ и энергии в организме
- •Глава 9. Обмен нуклеиновых кислот
- •9.1. Синтез пуриновых нуклеотидов.
- •9.2. Синтез пиримидиновых нуклеотидов
- •9.3. Биосинтез нуклеиновых кислот (биосинтез днк)
- •Распад нуклеиновых кислот
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 11. Обмен белков
- •10.1. Пути распада белков
- •10.2. Судьба всосавшихся аминокислот
- •10.3. Обезвреживание аммиака в организме
- •10.4. Биосинтез белка
- •Генетический кодовый «словарь»
- •10.4.1. Этапы синтеза белка
- •10.5. Регуляция синтеза белка
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 11. Обмен углеводов
- •11.1. Переваривание и всасывание углеводов
- •11.2. Синтез и распад гликогена
- •11.3. Окисление глюкозы
- •11.3.1. Гликолиз
- •Глюкоза Молочная кислота (2 мол)
- •11.3.2. Цикл Кребса
- •11.3.3. Цепь переноса электронов
- •11.4. Глюконеогенез
- •11.5. Пентозофосфатный путь окисления глюкозы
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 12. Обмен липидов
- •12.1. Переваривание и всасывание липидов
- •12.2. Окисление жирных кислот
- •12.3. Биосинтез жирных кислот
- •12.3.1. Биосинтез насыщенных жирных кислот
- •12.3.2. Биосинтез ненасыщенных жирных кислот
- •12.3.3. Синтез триглицеридов
- •12.3.4. Биосинтез холестерина
- •12.4. Нарушения липидного обмена
- •12.4.1. Ожирение
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 13. Биологическое окисление
- •13.1. Ферменты, катализирующие окислительно-восстановительные реакции
- •13.2. Классификация процессов биологического окисления
- •13.2.1. Свободное окисление
- •13.2.2. Окисление, сопряженное с фосфорилированием адф
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 14. Взаимосвязь процессов обмена веществ
- •Вопросы и задачи
- •Рекомендуемая литература
- •Библиографический список
- •Глава12. Обмен липидов 127
- •Глава13 . Биологическое окисление 141
- •Глава14. Взаимосвязь обмена веществ 145
12.2. Окисление жирных кислот
Жиры – основной источник энергии для синтеза АТФ. Они обеспечивают образование примерно половины энергии, потребляемой сердцем и покоящимися скелетными мышцами.
Распад жиров отличает универсальный механизм окисления жирных кислот путем последовательного отщепления от углеродной цепи двух углеродных атомов в виде ацетил-СоА. При этом образуются НФДН и ФАДH2.
Процесс окисления жирных кислот складывается из следующих этапов: активация жирных кислот, транспорт жирных кислот внутрь митохондрий, внутримитохондриальное окисление жирных кислот.
Активация жирных кислот протекает на наружной поверхности мембраны митохондрий при участии АТФ, коэнзима А (НS-KoА) и ионов Mg2+:
R-COOH + HS-KoA + ATF R-CO-S-KoA+ AMF + PPi
Реакцию активизации жирных кислот катализируют три родственных фермента – ацитил-СоА-синтетазы жирных кислот, специализирующиеся на кислотах с короткими, средними и длинными цепям.
Превращение жирных кислот в ацетил-CoA происходит в митохондриальном матриксе (рис. 40). Перенос жирнокислотного остатка в митохондрии осуществляет молекула карнитина.
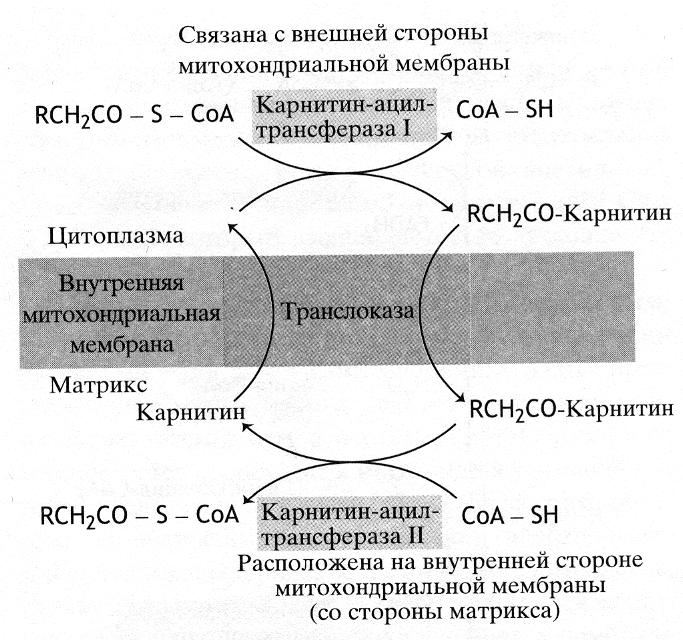
Рис. 40. Механизм транспорта жирных кислот в митохондрии
Ацильные производные карнитина проникают в матрикс, где протекает обратная реакция: ацильный остаток переносится с карнитина на тиольную группу свободного СоА, а карнитин возвращается назад за очередным остатком жирной кислоты.
Две реакции переноса ацильных групп – на карнитин и на митохондриальный СоА катализирует два фермента: первую, протекающую на внешней стороне митохондрии, карнитин-ацилтрансфераза I, а вторую имеющую место в матриксе, карнитин-ацилтрансфераза II.
Внутримитохондриальное окисление жирных кислот включает четыре последовательно протекающие реакции (дегидрирование, гидратация, дегидрирование, отщепление ацетил-КоА). Реакции окисления в радикале жирных кислот происходят по -углеродному атому, поэтому окисление называют -окислением (рис. 41).
Ацил-СоА-дегидрогеназа
Еноил-СоА-гидратаза
Кетоацил-СоА-тиолаза
Гидроксиацил-СоА-дегидрогеназа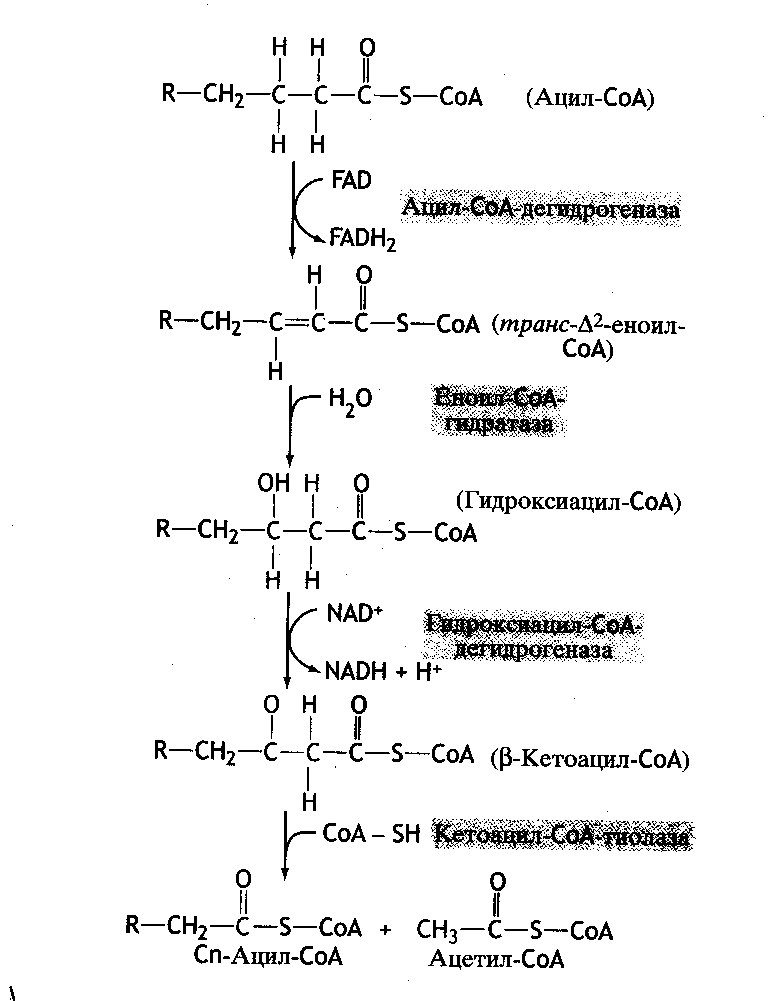
Рис. 41. -окисление жирных кислот
Эти реакции называют циклом -окисления, так как имеется в виду, что одни и те же реакции повторяются с радикалом жирной кислоты до тех пор, пока вся кислота не превратится в ацильные остатки.
Первой реакцией в каждом цикле распада ацил-КоА является его окисление ацил-КоА-дегидрогеназой, приводящее к образованию еноил-КоА с двойной связью между С-2 и С-3. Енол-КоА при участии фермента енол-КоА-гидратазы присоединяет молекулу воды. В результате образуется -оксиацил-КоА (или 3-гидроксиацил-КоА), который затем дегидрируется и превращается в -кетоацил-КоА (3-оксиацил-КоА).
Ключевой реакцией в метаболизме жиров служит реакция (тиолазная) взаимодействия КоА-SH с -кетоацил-КоА. В результате образуется укороченный на два углеродных атома ацил-КоА и двууглеродный фрагмент в виде ацетил-КоА. Реакция катализируется ацетил-КоА-ацилтрансферазой (-кетотиолазой).
Образовавшийся ацетил-КоА подвергается окислению в цикле трикарбоновых кислот, а ацил-КоА, укоротившийся на два углеродных атома, снова многократно проходит весь путь -окисления вплоть до образования бутирил-КоА (4-углеродное соединение), который в свою очередь окисляется до 2 молекул ацетил-КоА. Например, при окислении пальмитиновой кислоты (С16) повторяется 7 циклов -окисления.
При каждом цикле образуются одна молекула NADH и одна молекула FADH2, которые отдают свои электроны митохондриальной электроннотранспортной цепи.
Окисление ненасыщенных жирных кислот идет через дополнительные стадии, включающие перемещение двойной связи в углеводородной цепи жирной кислоты и перевод этой связи в транс-форму с помощью фермента изомеразы.
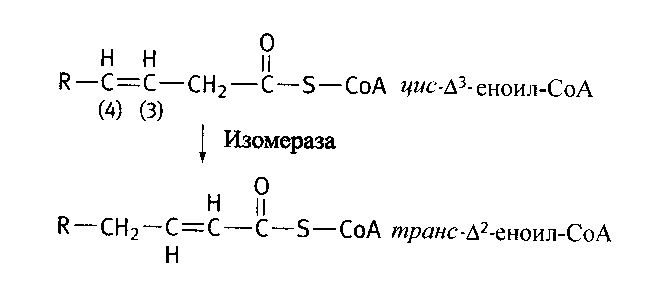
Примером может служить пальмитоолеиновая кислота с двойной связью между девятым и десятым атомами углерода. Вплоть до двойной связи цепь такой кислоты укорачивается обычным окислением с образованием цис-формы. Затем изомераза сдвигает двойную связь в нужное положение и образует транс-изомер, который становится субстратом енол-КоА-гидратазы.
