
- •Федеральное агентство по образованию
- •Рецензенты:
- •Предисловие
- •Введение
- •Часть I. Основные классы химических соединений, входящие в состав живой материи глава 1. Белки
- •1.1. Функции белков
- •1.2. Аминокислотный состав белков
- •1.3.Структурная организация белков
- •1.4. Физико-химические свойства белков
- •1.5. Классификация белков
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 2. Нуклеиновые кислоты
- •2.1. Химический состав нуклеиновых кислот
- •2.2. Структура нуклеиновых кислот
- •2.2.1. Структура днк
- •2.2.2. Структура рнк
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 3. Ферменты
- •3.1. Классификация ферментов и номенклатура
- •3.2. Активный центр ферментов
- •3.3. Механизм действия ферментов
- •3.4. Кинетика ферментативных реакций
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 4. Витамины
- •4.1. Классификация витаминов
- •4.2. Витамины, растворимые в жирах
- •4.3. Витамины, растворимые в воде
- •4.4. Витаминоподобные вещества
- •4.5. Антивитамины
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 5. Углеводы
- •5.1. Классификация углеводов
- •5.2. Моносахариды
- •Моносахариды
- •5.3. Олигосахариды
- •5.4. Полисахариды
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 6. Липиды
- •6.1. Классификация липидов
- •6.2. Жирные кислоты
- •6.3. Глицериды
- •6.4. Воска
- •6.5. Фосфолипиды
- •6.6. Гликолипиды (гликосфинголипиды)
- •6.7. Стероиды
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 7. Гормоны
- •7.1. Классификация гормонов
- •7.2. Гормоны гипоталамуса
- •7.3. Гормоны гипофиза
- •7.3.3. Гормоны передней доли гипофиза.
- •7.4. Гормоны паращитовидных желез (паратгормоны)
- •7.5. Гормоны щитовидной железы
- •7.6. Гормоны поджелудочной железы
- •7.7. Гормоны надпочечников
- •7.8. Половые гормоны
- •7.9. Гормоны вилочковой железы
- •7.10. Гормоны насекомых
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 8. Молекулярные механизмы гормонального сигнала
- •8.1. Механизм действия стероидных гормонов
- •8.2. Механизм действия гормонов пептидной природы
- •Вопросы и задачи
- •Рекомендуемая литература
- •Часть II. Обмен веществ и энергии в организме
- •Глава 9. Обмен нуклеиновых кислот
- •9.1. Синтез пуриновых нуклеотидов.
- •9.2. Синтез пиримидиновых нуклеотидов
- •9.3. Биосинтез нуклеиновых кислот (биосинтез днк)
- •Распад нуклеиновых кислот
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 11. Обмен белков
- •10.1. Пути распада белков
- •10.2. Судьба всосавшихся аминокислот
- •10.3. Обезвреживание аммиака в организме
- •10.4. Биосинтез белка
- •Генетический кодовый «словарь»
- •10.4.1. Этапы синтеза белка
- •10.5. Регуляция синтеза белка
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 11. Обмен углеводов
- •11.1. Переваривание и всасывание углеводов
- •11.2. Синтез и распад гликогена
- •11.3. Окисление глюкозы
- •11.3.1. Гликолиз
- •Глюкоза Молочная кислота (2 мол)
- •11.3.2. Цикл Кребса
- •11.3.3. Цепь переноса электронов
- •11.4. Глюконеогенез
- •11.5. Пентозофосфатный путь окисления глюкозы
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 12. Обмен липидов
- •12.1. Переваривание и всасывание липидов
- •12.2. Окисление жирных кислот
- •12.3. Биосинтез жирных кислот
- •12.3.1. Биосинтез насыщенных жирных кислот
- •12.3.2. Биосинтез ненасыщенных жирных кислот
- •12.3.3. Синтез триглицеридов
- •12.3.4. Биосинтез холестерина
- •12.4. Нарушения липидного обмена
- •12.4.1. Ожирение
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 13. Биологическое окисление
- •13.1. Ферменты, катализирующие окислительно-восстановительные реакции
- •13.2. Классификация процессов биологического окисления
- •13.2.1. Свободное окисление
- •13.2.2. Окисление, сопряженное с фосфорилированием адф
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 14. Взаимосвязь процессов обмена веществ
- •Вопросы и задачи
- •Рекомендуемая литература
- •Библиографический список
- •Глава12. Обмен липидов 127
- •Глава13 . Биологическое окисление 141
- •Глава14. Взаимосвязь обмена веществ 145
Глюкоза Молочная кислота (2 мол)
Рис. 26. Последовательность реакций гликолиза
1 гексокиназа, 2 фосфоглюкоизомераза, 3 фосфофруктокиназа, 4 альдолаза, 5 триозофосфоизомераза, 6 глицеральдегидфосфатдегидрогеназа, 7 фосфоглицераткиназа, 8 фосфоглицератмутаза, 9 енолаза, 10 пируваткиназа, 11 лактатдегидрогеназа
Биологическое значение процесса гликолиза заключается прежде всего в образовании богатых энергией фосфатных соединений. На первых стадиях гликолиза затрачиваются 2 молекулы АТФ (гексокиназная и фосфофруктокиназная реакции). На последующих образуется 4 молекулы АТФ (фосфоглицераткиназная и пируваткиназная реакции). Таким образом, энергетическая эффективность гликолиза составляет 2 молекулы АТФ на одну молекулу глюкозы.
Если гликолиз протекает в аэробных условиях, пируват и НАДН поступают в митохондрии, где пируват окисляется до СО2 и НО2, а НАДН в НАД.
При анаэробном гликолизе происходит образование молочной кислоты из пирувата. Анаэробный гликолиз происходит в мышцах в первые минуты мышечной работы, в эритроцитах, в которых нет митохондрий, а также в различных органах и тканях при недостаточном снабжении их кислородом.
У многих микроорганизмов, растущих в анаэробных условиях, гликолиз является основным катаболитическим путем, предназначенным для извлечения пирувата из углеводных субстратов; дальнейшее превращение пирувата приводит к образованию определенных конечных продуктов метаболизма – продуктов брожения. Химическая природа этих продуктов зависит от вида микроорганизма и условий протекания процесса, в которых один и тот же микроорганизм осуществляет брожение.
Основными типами брожений являются спиртовое, молочнокислое, маслянокислое и др.
11.3.2. Цикл Кребса
Цикл лимонной кислоты (цикл Кребса, цикл лимонной кислоты) представляет серию реакций, протекающих в митохондрий.
Пируват, образовавшийся при гликолизе, попадает внутрь митохондрий, благодаря транспортной системы, обеспечивающей его антипорт с ионами ОН-.
Ацетильные углеродные атомы с ацетил-КоА, которые ранее принадлежали пирувату, превращаются в СО2, и параллельно с этим 3 молекулы НАД+ восстанавливаются в НАНД, а 1 молекула ФАД – в ФАДH2. Кроме того, следствием всех этих превращений является синтез ГТФ.
В матриксе митохондрий пируват превращается в ацетил-КоА, после чего ацильная группа пирувата вступает в цикл лимонной кислоты.
Окисление пирувата до ацетил-КоА происходит при участии ряда ферментов и коферментов, объединенных структурно в мультиферментную систему, получившую название «пируватдегидрогеназный комплекс» (рис.27).
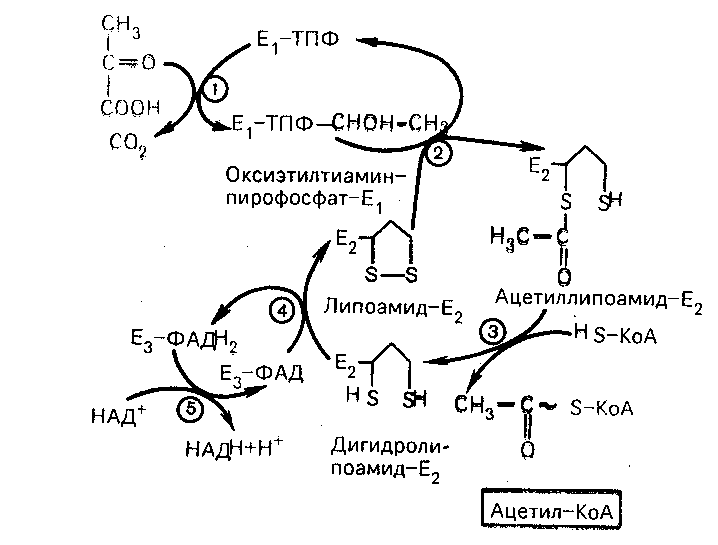
Рис 27. Механизм действия пируватдегидрогеназного комплекса
Е1 пируватдегидрогеназа, Е2 дигидролипоилацетилтрансфераза, Е3 дигидролипоилдегидрогеназа
На I стадии этого процесса пируват теряет свою карбоксильную группу в результате взаимодействия с тиаминпирофосфатом (ТПФ) в составе активного центра фермента пируватдегидрогеназы (Е1). На II второй стадии оксиэтильная группа комплекса Е1 ТПФ СНОН СН3 окисляется с образованием ацетильной группы, которая одновременно переносится на амид липоевой кислоты (кофермент), связанной с ферментом дигидролипоилацетилтрансферазой (Е2). Этот фермент катализирует III стадию – перенос ацетильной группы на коэнзим КоА (HS-КоА) с образованием конечного продукта ацетил-КоА, который является высокоэнергетическим (макроэргическим) соединением.
На IV стадии регенерируется окисленная форма липоамида из восстановленного комплекса дигидролипоамид-Е2. При участии фермента дигидролипоилдегидрогеназы (Е3) осуществляется перенос атомов водорода от восстановленных сульфгидрильных групп дигидролипоамида на ФАД, который выполняет роль простетической группы данного фермента и прочно с ним связан. На V стадии восстановленный в ФАДH2 дигидролипоилдегидрогенеазы передает водород на кофермент НАД+ с образованием НАДН + Н+.
Образовавшийся в результате окислительного декарбоксилирования пирувата в митохондриях, ацетил-КоА вступает в цикл Кребса. Данный цикл происходит в матриксе митохондрий и состоит из восьми последовательных реакций (рис 28).
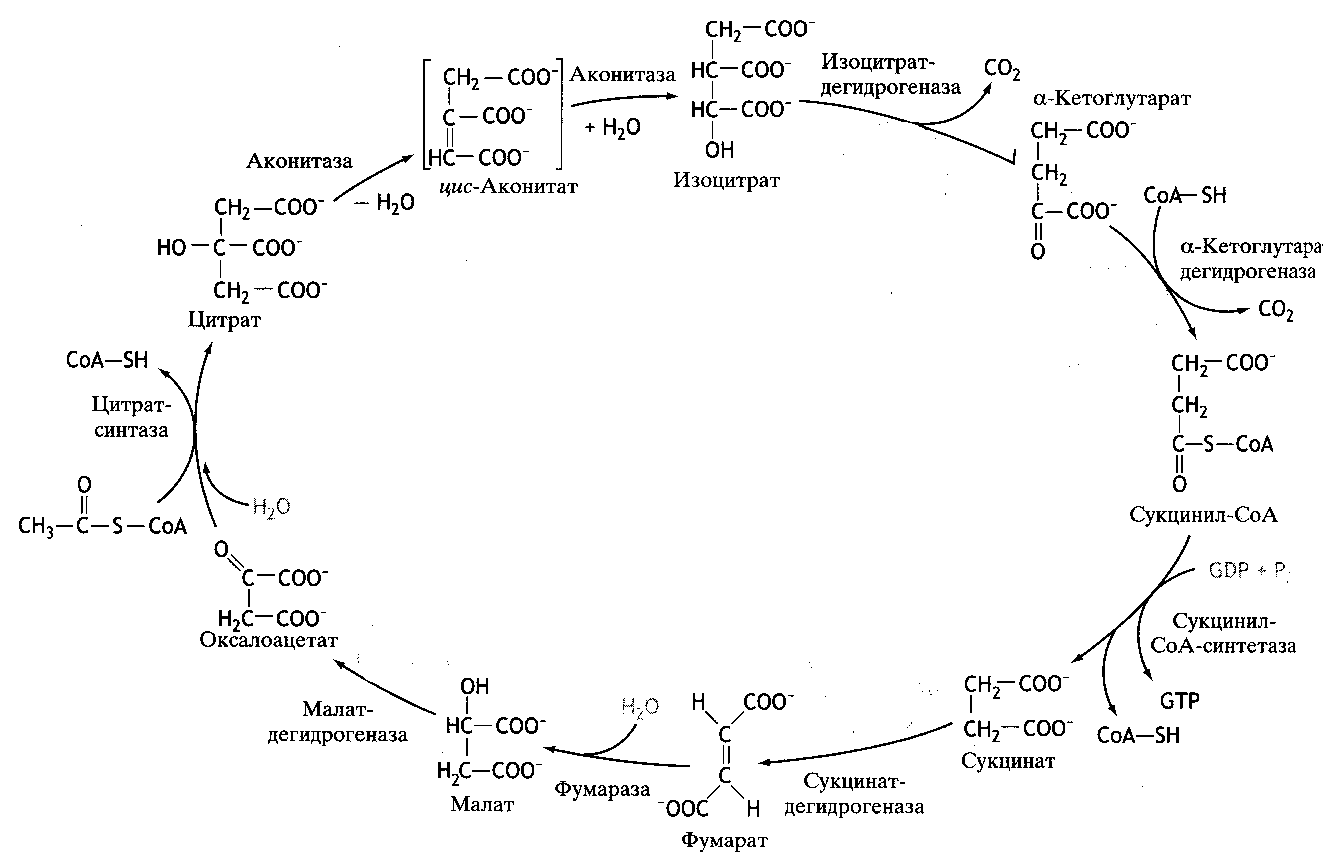
Рис. 28. Цикл Кребса (цикл лимонной кислоты)
Начинается цикл с присоединения ацетил-КоА к оксалоацетату и образования лимонной кислоты (цитрата). Затем лимонная кислота (шестиуглеродное соединение) путем ряда дегидрирований (отнятия водорода) и двух декрбоксилирований (отщепления СО2) теряет два углеродных атома и снова в цикле Кребса превращается в оксалоацетат (четырехуглеродное соединение), т.е. в результате полного оборота цикла одна молекула ацетил-КоА сгорает до СО2 и НО2, а молекула оксалоацетата регенерируется.
Первая реакция катализируется ферментом цитратсинтетазой, при этом ацетильная группа ацетил-КоА конденсируется с оксалоацетатом, в результате образуется лимонная кислота:

В результате второй реакции образовавшаяся лимонная кислота подвергается дегидрированию с образованием цис-аконитовой кислоты, которая, присоединяя молекулу воды, переходит в изолимонную кислоту (изоцитрат). Катализирует эти обратимые реакции гидратации–дегидратации фермент аконитатгидратаза (аконитаза). В результате происходит взаимопревращение Н и ОН в молекуле цитрата:
В третьей реакции изолимонная кислота дегидрируется в присутствии НАД-зависимой изоцитратдегидрогеназы:
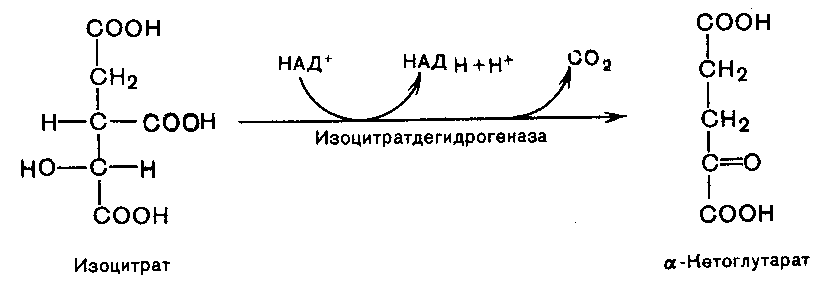
В ходе изоцитратдегидрогеназной реакции изолимонная кислота одновременно декарбоксилируется. НАД-зависимая изоцитратдегидрогеназа является аллостерическим ферментом, которому в качестве специфического активатора необходим АДФ и для проявления своей активности фермент нуждается в Mg2+ и Mn2+.
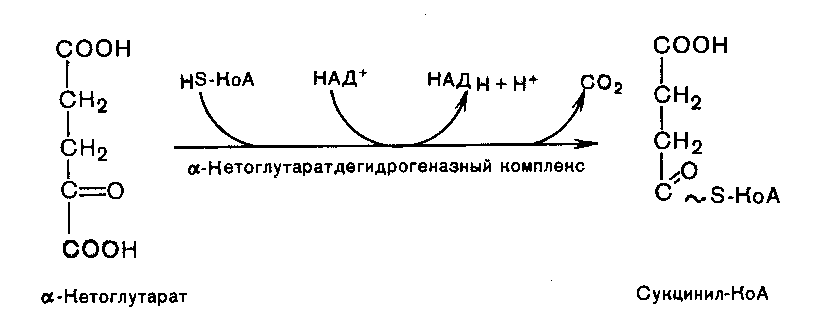
Во время четвертой реакции происходит окислительное декарбоксилирование -кетоглутаровой кислоты с образованием высокоэнергетического соединения сукцинил-КоА. В реакции участвуют 5 коферментов: ТПФ, амид липоевой кислоты, HS-КоА, ФАД и НАД+:
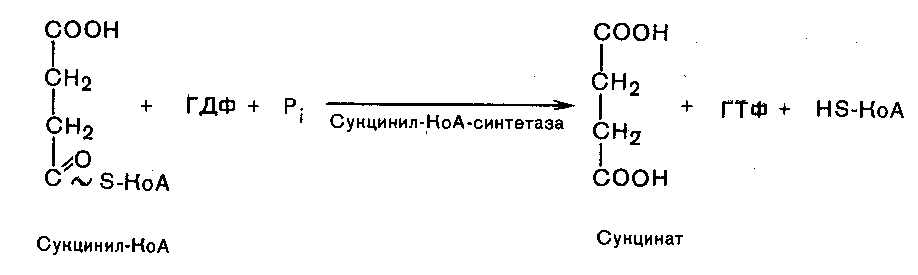
Пятая реакция катализируется ферментом сукцинил-КоА-синтетазой. В ходе этой реакции сукцинил-КоА при участии ГТФ и неорганического фосфата превращается в янтарную кислоту (сукцинат). Одновременно происходит образование высокоэргической связи ГТФ за счет высокоэргической тиоэфирной связи сукцинил-КоА:
В результате шестой реакции сукцинат дегидрируется в фумаровую кислоту. Окисление сукцината катализируется сукцинатдегидрогеназой, в молекуле которой с белком прочно (ковалентно) связан кофермент ФАД. В свою очередь, сукцинатдегидрогеназа прочно связана с внутренней митохондриальной мембраной:

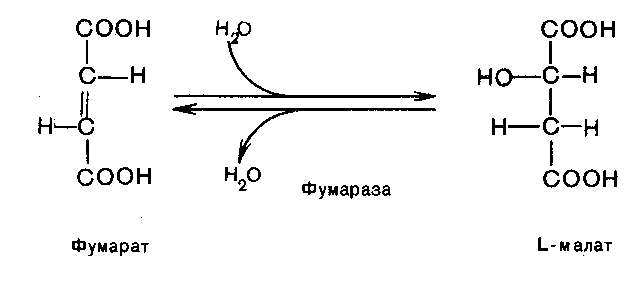
Седьмая реакция осуществляется под влиянием фермента фумаратдегидратазы (фумаразы). Образовавшаяся при этом фумаровая кислота гидратируется, продуктом реакции является L-яблочная кислота (малат):
В восьмой реакции цикла под влиянием митохондрильной НАД-зависимой малатдегидрогеназы происходит окисление L-малата в оксалоацетат:

За один оборот цикла происходит полное окисление («сгорание») одной молекулы ацетил-КоА. Для непрерывной работы цикла необходимо постоянное поступление в систему ацетил-КоА, а коферменты (НАД+ и ФАД), перешедшие в восстановленное состояние, должны окисляться в системе переносчиков электронов в дыхательной цепи (в цепи дыхательных ферментов), локализованных во внутренней мембране митохондрий.
При окислении глюкозы в результате гликолиза и цикла Кребса образуется: 2 молекулы АТФ на 1 молекулу глюкозы в процессе гликолиза и столько же в цикле лимонной кислоты (с учетом энергетической эквивалентности ГТФ и АТФ); еще одна молекула АТФ образуется, если источником глюкозы служит гликоген. Большая часть энергии запасается в виде 10 молекул НАДН (две из гликолиза, две из пируватдегидрогеназной реакции и шесть из цикла лимонной кислоты) и 2 молекулы ФАДН2 (из цикла лимонной кислоты). Следует помнить, что из глюкозы образуется 2 молекулы пирувата, которые обеспечивают 2 оборота цикла.
Основное количество АТФ, синтезируемого из АДФ и Р в ходе окисления глюкозы, образуется при окислении ФАД и НАД+.
