
- •Федеральное агентство по образованию
- •Рецензенты:
- •Предисловие
- •Введение
- •Часть I. Основные классы химических соединений, входящие в состав живой материи глава 1. Белки
- •1.1. Функции белков
- •1.2. Аминокислотный состав белков
- •1.3.Структурная организация белков
- •1.4. Физико-химические свойства белков
- •1.5. Классификация белков
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 2. Нуклеиновые кислоты
- •2.1. Химический состав нуклеиновых кислот
- •2.2. Структура нуклеиновых кислот
- •2.2.1. Структура днк
- •2.2.2. Структура рнк
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 3. Ферменты
- •3.1. Классификация ферментов и номенклатура
- •3.2. Активный центр ферментов
- •3.3. Механизм действия ферментов
- •3.4. Кинетика ферментативных реакций
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 4. Витамины
- •4.1. Классификация витаминов
- •4.2. Витамины, растворимые в жирах
- •4.3. Витамины, растворимые в воде
- •4.4. Витаминоподобные вещества
- •4.5. Антивитамины
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 5. Углеводы
- •5.1. Классификация углеводов
- •5.2. Моносахариды
- •Моносахариды
- •5.3. Олигосахариды
- •5.4. Полисахариды
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 6. Липиды
- •6.1. Классификация липидов
- •6.2. Жирные кислоты
- •6.3. Глицериды
- •6.4. Воска
- •6.5. Фосфолипиды
- •6.6. Гликолипиды (гликосфинголипиды)
- •6.7. Стероиды
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 7. Гормоны
- •7.1. Классификация гормонов
- •7.2. Гормоны гипоталамуса
- •7.3. Гормоны гипофиза
- •7.3.3. Гормоны передней доли гипофиза.
- •7.4. Гормоны паращитовидных желез (паратгормоны)
- •7.5. Гормоны щитовидной железы
- •7.6. Гормоны поджелудочной железы
- •7.7. Гормоны надпочечников
- •7.8. Половые гормоны
- •7.9. Гормоны вилочковой железы
- •7.10. Гормоны насекомых
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 8. Молекулярные механизмы гормонального сигнала
- •8.1. Механизм действия стероидных гормонов
- •8.2. Механизм действия гормонов пептидной природы
- •Вопросы и задачи
- •Рекомендуемая литература
- •Часть II. Обмен веществ и энергии в организме
- •Глава 9. Обмен нуклеиновых кислот
- •9.1. Синтез пуриновых нуклеотидов.
- •9.2. Синтез пиримидиновых нуклеотидов
- •9.3. Биосинтез нуклеиновых кислот (биосинтез днк)
- •Распад нуклеиновых кислот
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 11. Обмен белков
- •10.1. Пути распада белков
- •10.2. Судьба всосавшихся аминокислот
- •10.3. Обезвреживание аммиака в организме
- •10.4. Биосинтез белка
- •Генетический кодовый «словарь»
- •10.4.1. Этапы синтеза белка
- •10.5. Регуляция синтеза белка
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 11. Обмен углеводов
- •11.1. Переваривание и всасывание углеводов
- •11.2. Синтез и распад гликогена
- •11.3. Окисление глюкозы
- •11.3.1. Гликолиз
- •Глюкоза Молочная кислота (2 мол)
- •11.3.2. Цикл Кребса
- •11.3.3. Цепь переноса электронов
- •11.4. Глюконеогенез
- •11.5. Пентозофосфатный путь окисления глюкозы
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 12. Обмен липидов
- •12.1. Переваривание и всасывание липидов
- •12.2. Окисление жирных кислот
- •12.3. Биосинтез жирных кислот
- •12.3.1. Биосинтез насыщенных жирных кислот
- •12.3.2. Биосинтез ненасыщенных жирных кислот
- •12.3.3. Синтез триглицеридов
- •12.3.4. Биосинтез холестерина
- •12.4. Нарушения липидного обмена
- •12.4.1. Ожирение
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 13. Биологическое окисление
- •13.1. Ферменты, катализирующие окислительно-восстановительные реакции
- •13.2. Классификация процессов биологического окисления
- •13.2.1. Свободное окисление
- •13.2.2. Окисление, сопряженное с фосфорилированием адф
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 14. Взаимосвязь процессов обмена веществ
- •Вопросы и задачи
- •Рекомендуемая литература
- •Библиографический список
- •Глава12. Обмен липидов 127
- •Глава13 . Биологическое окисление 141
- •Глава14. Взаимосвязь обмена веществ 145
10.3. Обезвреживание аммиака в организме
Реакции дезаминирования аминокислот и азотистых оснований, окисление биогенных аминов приводят к образованию в тканях токсичного для организма аммиака. Аммиак токсичен и его содержание в крови должно быть предельно мало, иначе возможно нарушение функции мозга и развитие комы. В растениях аммиак содержится также в незначительных количествах. В живых организмах существуют механизмы обезвреживания аммиака.
Одним из путей связывания и обезвреживания аммиака является биосинтез глутамина (возможно аспарагина).
Основной механизм обезвреживания аммиака – биосинтез мочевины. Мочевина выводится с мочой; у растений может накапливаться в заметных количествах, особенно в растениях, имеющих на корнях микоризу.
Основным местом синтеза мочевины является печень. Образование мочевины происходит в результате нескольких ферментативных реакций, которые составляют орнитиновый цикл. Г.Кребс и К.Гензеляйт впервые в 1932 г. вывели уравнения реакций синтеза мочевины (рис.21).
Образование мочевины протекает в несколько этапов. На первом этапе синтезируется макроэргическое соединение карбомоилфосфат – метаболитически активная форма аммиака, используемая в качестве исходного продукта для синтеза пиримидиновых нуклеотидов и аргинина. В настоящее время открыты три разных пути синтеза карбомоилфосфата.
Первая реакция (необратимая) идет при участии фермента –аммиакзависимой карбомоилфосфатсинтетазы:
![]()
Реакция требует затраты двух молекул АТФ, открыта в митохондриях клеток печени и используется преимущественно для синтеза аргинина и мочевины.
Вторую, также необратимую, реакцию катализирует глутаминзависимая карбомоилфосфатсинтетаза:
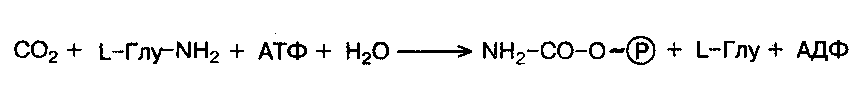
Реакция открыта в цитозоле клеток животных и требует наличия ионов Mg2+.
Третью обратимую реакцию катализирует карбаматкиназа (реакция открыта у микроорганизмов).
![]()
На втором этапе цикла мочевинообразования происходит конденсация кабомолфосфата и орнитина с образованием цитруллина; реакцию катализирует орнитин-карбомоилтрансфераза. На следующей стадии цитруллин превращается в аргинин в результате двух последующих реакций. Первая из них – конденсация цитруллина и аспарагиновой кислоты с образованием аргининосукцината (реакцию катализирует аргининосукцинатлиаза). Аргининосукцинат распадается в следующей реакции на аргинин и фумарат при участии аргининосукцинатлиазы. На последнем этапе аргинин расщепляется на мочевину и орнитин под действием аргиназы.
На синтез одной молекулы мочевины требуется затрата четырех высокоэнергетических фосфатных групп: две молекулы АТФ расходуются на синтез карбомоилфосфата и одна на образование аргининоянтарной кислоты, при этом АТФ расщепляется на АМФ и РРi, который при гидролизе также образует две молекулы Рi.
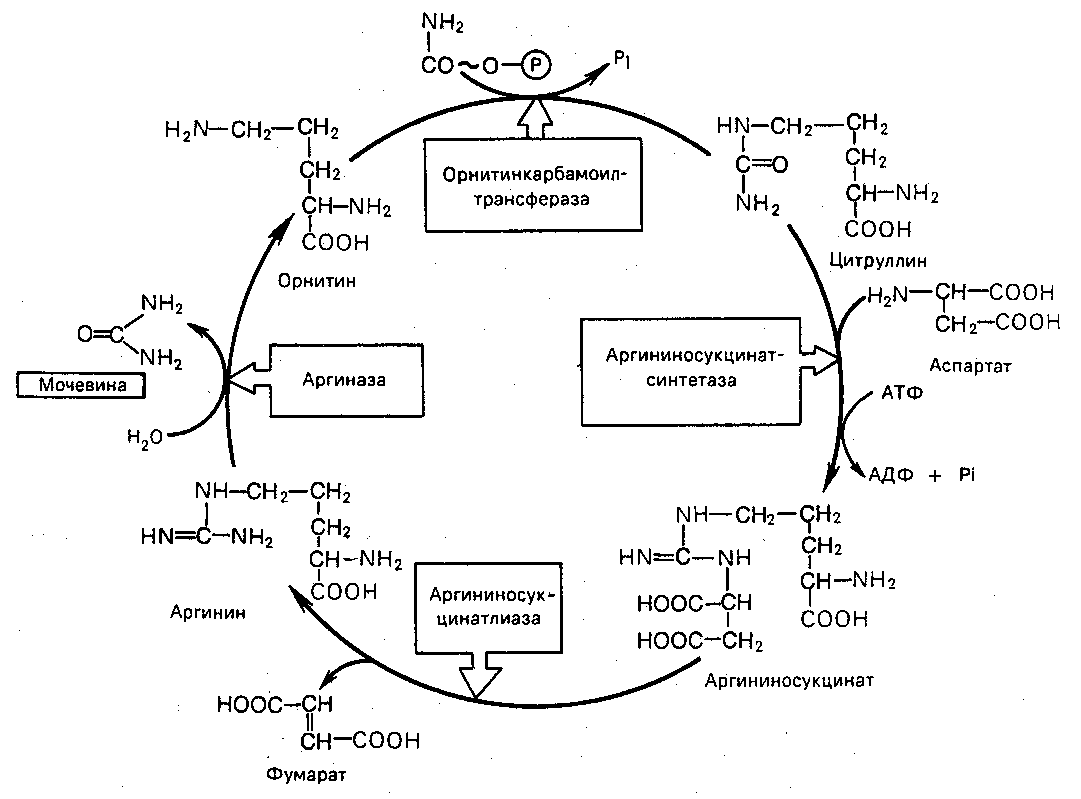
Рис. 21. Орнитиновый цикл синтеза мочевины в печени
В процессе эволюции живые организмы выработали различные типы азотистого обмена. Это аммониотелический тип, при котором главным конечным продуктом азотистого обмена является аммиак; он свойствен преимущественно рыбам. При уреотелическом типе обмена основным конечным продуктом обмена является мочевина; такой тип характерен для человека и животных. Урикотелический тип характерен для птиц и рептилий; главным конечным продуктом данного типа обмена является мочевая кислота.
