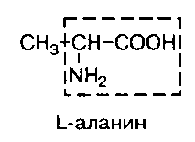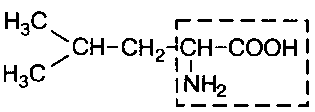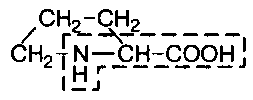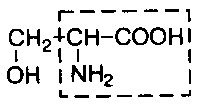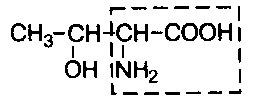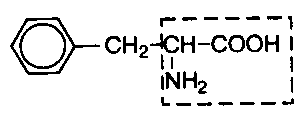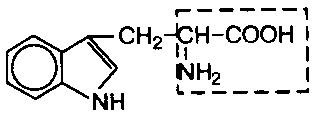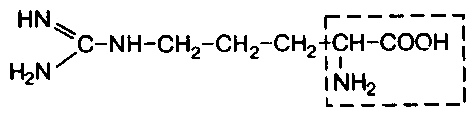- •Федеральное агентство по образованию
- •Рецензенты:
- •Предисловие
- •Введение
- •Часть I. Основные классы химических соединений, входящие в состав живой материи глава 1. Белки
- •1.1. Функции белков
- •1.2. Аминокислотный состав белков
- •1.3.Структурная организация белков
- •1.4. Физико-химические свойства белков
- •1.5. Классификация белков
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 2. Нуклеиновые кислоты
- •2.1. Химический состав нуклеиновых кислот
- •2.2. Структура нуклеиновых кислот
- •2.2.1. Структура днк
- •2.2.2. Структура рнк
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 3. Ферменты
- •3.1. Классификация ферментов и номенклатура
- •3.2. Активный центр ферментов
- •3.3. Механизм действия ферментов
- •3.4. Кинетика ферментативных реакций
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 4. Витамины
- •4.1. Классификация витаминов
- •4.2. Витамины, растворимые в жирах
- •4.3. Витамины, растворимые в воде
- •4.4. Витаминоподобные вещества
- •4.5. Антивитамины
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 5. Углеводы
- •5.1. Классификация углеводов
- •5.2. Моносахариды
- •Моносахариды
- •5.3. Олигосахариды
- •5.4. Полисахариды
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 6. Липиды
- •6.1. Классификация липидов
- •6.2. Жирные кислоты
- •6.3. Глицериды
- •6.4. Воска
- •6.5. Фосфолипиды
- •6.6. Гликолипиды (гликосфинголипиды)
- •6.7. Стероиды
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 7. Гормоны
- •7.1. Классификация гормонов
- •7.2. Гормоны гипоталамуса
- •7.3. Гормоны гипофиза
- •7.3.3. Гормоны передней доли гипофиза.
- •7.4. Гормоны паращитовидных желез (паратгормоны)
- •7.5. Гормоны щитовидной железы
- •7.6. Гормоны поджелудочной железы
- •7.7. Гормоны надпочечников
- •7.8. Половые гормоны
- •7.9. Гормоны вилочковой железы
- •7.10. Гормоны насекомых
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 8. Молекулярные механизмы гормонального сигнала
- •8.1. Механизм действия стероидных гормонов
- •8.2. Механизм действия гормонов пептидной природы
- •Вопросы и задачи
- •Рекомендуемая литература
- •Часть II. Обмен веществ и энергии в организме
- •Глава 9. Обмен нуклеиновых кислот
- •9.1. Синтез пуриновых нуклеотидов.
- •9.2. Синтез пиримидиновых нуклеотидов
- •9.3. Биосинтез нуклеиновых кислот (биосинтез днк)
- •Распад нуклеиновых кислот
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 11. Обмен белков
- •10.1. Пути распада белков
- •10.2. Судьба всосавшихся аминокислот
- •10.3. Обезвреживание аммиака в организме
- •10.4. Биосинтез белка
- •Генетический кодовый «словарь»
- •10.4.1. Этапы синтеза белка
- •10.5. Регуляция синтеза белка
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 11. Обмен углеводов
- •11.1. Переваривание и всасывание углеводов
- •11.2. Синтез и распад гликогена
- •11.3. Окисление глюкозы
- •11.3.1. Гликолиз
- •Глюкоза Молочная кислота (2 мол)
- •11.3.2. Цикл Кребса
- •11.3.3. Цепь переноса электронов
- •11.4. Глюконеогенез
- •11.5. Пентозофосфатный путь окисления глюкозы
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 12. Обмен липидов
- •12.1. Переваривание и всасывание липидов
- •12.2. Окисление жирных кислот
- •12.3. Биосинтез жирных кислот
- •12.3.1. Биосинтез насыщенных жирных кислот
- •12.3.2. Биосинтез ненасыщенных жирных кислот
- •12.3.3. Синтез триглицеридов
- •12.3.4. Биосинтез холестерина
- •12.4. Нарушения липидного обмена
- •12.4.1. Ожирение
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 13. Биологическое окисление
- •13.1. Ферменты, катализирующие окислительно-восстановительные реакции
- •13.2. Классификация процессов биологического окисления
- •13.2.1. Свободное окисление
- •13.2.2. Окисление, сопряженное с фосфорилированием адф
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 14. Взаимосвязь процессов обмена веществ
- •Вопросы и задачи
- •Рекомендуемая литература
- •Библиографический список
- •Глава12. Обмен липидов 127
- •Глава13 . Биологическое окисление 141
- •Глава14. Взаимосвязь обмена веществ 145
Часть I. Основные классы химических соединений, входящие в состав живой материи глава 1. Белки
Белки, протеины (от греч. «protos» – первый, важнейший) – высокомолекулярные органические соединения, построенные из остатков аминокислот. Этот класс веществ является важнейшим и играет первостепенную роль в жизнедеятельности всех организмов.
На долю белков приходится не менее 50% сухой массы органических соединений живой клетки. Белки обладают наибольшим по сравнению с другими веществами органической природы разнообразием структур и функций. Именно белки определяют, в конечном счете, фенотип любого организма, формируют облик всех живых систем.
1.1. Функции белков
Белки разнообразны по структуре и выполняют многочисленные биологические функции. Ни один класс биологически активных веществ не наделен такими свойствами, ни один биологический процесс не протекает без прямого или косвенного участия белков.
Белкам присуща каталитическая функция, так как к ним относятся ферменты, являющиеся высокоспецифическими катализаторами биохимических реакций.
Благодаря транспортной функции осуществляется перенос ионов, липидов, сахаров, аминокислот через биологические мембраны. Процесс осуществляется при участии транспортных белков или белков-переносчиков; кислород переносится с помощью гемоглобина и миоглобина.
Специфические защитные белки активизируются в ответ на поступление в организм чужеродных веществ (вирусов, бактерий и т.д.). Белки плазмы крови участвуют в свертывании крови и предохраняют организм от потери крови при ранениях.
Двигательные (сократительные) белки осуществляют работу мышц, расхождение хромосом при делении клеток, движение жгутиков.
Важную группу составляют регуляторные белки, контролирующие биосинтез белков и нуклеиновых кислот. Белковые гормоны участвуют в регуляции обмена веществ в организме.
Рецепторные белки, располагающиеся на плазматической мембране, принимают участие в восприятии информации о состоянии внешней среды и передают ее внутрь клетки при участии комплекса сигнальных систем.
Запасные белки растений и животных выполняют питательную (резервную) функцию. К ним относятся, например, белки яйца (овальбумин), молока (казеин) и другие.
Биологическая активность белков, разнообразие выполняемых ими функций обусловлены необыкновенной пластичностью и строгой упорядоченностью структуры белков.
1.2. Аминокислотный состав белков
В состав белков входит множество различных аминокислот, отличающихся строением радикала. Природа использует в белках двадцать α-аминокислот (табл.1). α-аминокислоты представляют собой производные карбоновых кислот, у которых один водородный атом, у α-углерода, замещен на аминогруппу (NH2). Общая формула аминокислот: H2N – CH(R) – COOH, где R – боковая цепь (радикал).
Все разнообразие особенностей структуры и функций белковых молекул связано с химической природой и физико-химическими свойствами радикалов аминокислот. В таблице 1 представлены формулы 20 аминокислот и трехбуквенные сокращенные обозначения, указаны также заменимые и незаменимые аминокислоты. Заменимые могут синтезироваться в организме, незаменимые не синтезируются и должны поступать с пищей.
Таблица 1
Классификация аминокислот
№ п/п |
Название аминокислот |
Сокращенное название |
Формула |
I. Аминокислоты, содержащие неполярные (гидрофобные) радикалы |
|||
1. |
Глицин |
Гли |
|
2. |
Аланин (незам. для детей) |
Ала |
|
3. |
Валин (незам.) |
Вал |
|
4. |
Лейцин (незам.) |
Лей |
|
5. |
Изолейцин (незам.) |
Иле |
|
6. |
Пролин |
Про |
|
II. Аминокислоты, содержащие полярные (гидрофильные) радикалы |
|||
7. |
Серин |
Сер |
|
8. |
Треонин (незам.) |
Тре |
|
9. |
Цистеин |
Цис |
|
10. |
Метионин (незам.) |
Мет |
|
11. |
Аспарагин |
Асн |
|
12. |
Глутамин |
Глн |
|
Окончание таблицы 1
№ п/п |
Название аминокислот |
Сокращенное название |
Формула |
||
III. Аминокислоты, содержащие ароматические радикалы |
|||||
13. |
Фенилаланин (незам.) |
Фен |
|
||
14. |
Тирозин |
Тир |
|
||
15. |
Триптофан (незам.) |
Трп |
|
||
IV. Аминокислоты, содержащие отрицательно заряженные радикалы |
|||||
16. |
Аспарагиновая кислота |
Асп |
|
||
17. |
Глутаминовая кислота |
Глу |
|
||
V. Аминокислоты, содержащие положительно заряженные радикалы |
|||||
18. |
Лизин (незам.) |
Лиз |
|
||
19. |
Аргинин |
Арг |
|
||
20. |
Гистидин (незам. для детей) |
Гис |
|
||
Классификация аминокислот основана на полярности радикалов, т.е. способности их к взаимодействию с водой при физиологических значениях рН. Различают пять классов аминокислот, содержащих следующие радикалы: 1) неполярные (гидрофобные); 2) полярные (гидрофильные); 3) ароматические (большей частью неполярные); 4) отрицательно заряженные; 5) положительно заряженные.
Для аминокислот характерна оптическая изомерия. Все природные аминокислоты обычно относятся к L-ряду (исключение составляет глицин, не имеющий хирального углеродного атома). D-формы аминокислот обнаруживаются в составе белков достаточно редко. Они выявлены в клеточной стенке некоторых бактерий, в составе некоторых антибиотиков.
В водных растворах аминокислоты находятся в виде амфотерных ионов. На ионизацию аминокислот в водных растворах большое влияние оказывает значение рН среды. В кислой среде аминокислоты заряжены положительным электрическим зарядом, в щелочной – отрицательным. Состояние аминокислоты, когда ее суммарный электрический заряд равен нулю, называется изоэлектрической точкой аминокислоты (ИЭТ). В ИЭТ амфотерные электролиты обладают минимумом растворимости, минимальной буферной емкостью.
Благодаря наличию карбоксильных и аминогрупп, аминокислоты имеют свои специфические химические реакции, нашедшие применение при разделении, идентификации и количественном определении аминокислот.
Аминокислоты способны реагировать своими карбоксильными группами со спиратами, образуя сложные эфиры:
1
В специфических реакциях аминокислот особую роль играет реакционная способность -аминогруппы. Аминокислоты могут реагировать с азотистой кислотой, образуя при этом гидроксикислоту и газообразный азот:
2
-Аминогруппа аминокислот может вступать с формальдегидом:
3
Для обнаружения, идентификации и количественного анализа широкое применение нашла цветная реакция с нингидрином:
4
При рН 5,5 и нагревании с избытком нингидрина аминокислота дегидрируется, декарбоксилируется с образованием СО2, NH3 и альдегида, а нингидрин превращается в восстановленный нингидрин. Нингидрин, восстановленный нингидрин и аммиак затем конденсируются с образованием окрашенного соединения, причем образуется пигмент сине-фиолетового цвета, если аминокислота содержит свободную аминогруппу, и желтый пигмент, если - аминогруппа замещена, как например, у проилина, гидроксипролина. Интенсивность окраски можноиспользовать для колориметрического определения концентрации аминокислот, например, в белковых гидролизатах после разделения аминокислот бумажной, ионообменной хромотографией или электрофорезом.
При слабощелочных значениях рН и комнатной температуре аминокислоты вступают в реакцию с 1-фтор -2,4-нититробензолом:
5
Аналогичная реакция с -аминогруппой осуществляется с фенилизотиоцианатом:
6